教学目标
知识目标
使学生了解强电解质和弱电解质的含义;
使学生了解和方程式的含义;
使学生了解发生的条件和方程式的书写方法。
能力目标
通过对中和反应、碳酸根离子检验等知识的综合运用,培养学生分析问题、解决问题的能力,训练学生的科学方法,加深学生对所学知识的理解。
情感目标
通过教学对学生进行科学态度和科学方法教育。
教学建议
重点与难点
教学重点:强电解质和弱电解质、和方程式的书写方法。
教学难点:方程式的书写。
教学建议
是电解质在溶液里发生的反应,或在溶液里生成电解质的反应。
要正确书写方程式,必须掌握电解质、电离、电离方程式和酸、碱、盐的溶解性等知识。
教学过程可采用:实验→观察→分析→结论的程序进行教学。具体建议如下:
一、精心设计,并做好强弱电解质水溶液导电性强弱的实验,再引导学生根据实验现象推理,是建立强弱电解质概念的关键。教师要强调比较导电性强弱时,必须条件相同。在演示实验中引导学生观察,比较灯光的亮度,讨论推断:灯光亮度不同→溶液的导电性不同→溶液里自由移动的离子浓度不同→电解质电离程度不同→电解质有强弱之分。从而为理解打下良好的基础。
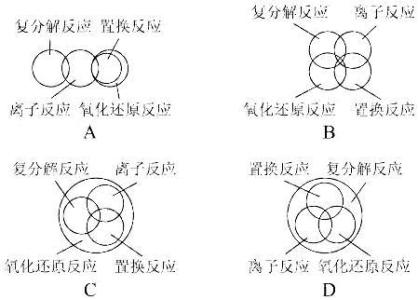
二、由于学生学过的化学反应不太多,本节只要求学生掌握离子互换反应和有离子参加的置换反应两类,不要再扩大。
做好教材中的演示实验,让学生展开讨论,引导学生运用电解质在水中发生电离,电离方程式等知识进行分析,并联系复分解反应趋于完成的条件,得出“电解质在溶液里发生反应的实质是离子间的反应”这一新课题。理解总是向离子浓度降低的方向进行的道理。最后过渡到为表示反应的本质,用实际参加反应的离子来表示化学反应,即离子方程式的教学。
三、书写方程式是本节的难点。
建议1.初学时按书写步骤进行训练。2.步骤中的第二步是正确书写方程式的关键。学生的主要错误是不熟悉酸、碱、盐的溶解性表。教师可帮助学生抓住若干条规律,记住常见物质的溶解性,这样有利于教学。3.强调方程式所表示的意义,加强读出离子方程式正确含义的训练。学生练习化学方程式改写成离子方程式和由离子方程式写出相应的化学方程式。
教学设计示例
教学重点:和方程式的书写。
教学难点:方程式的书写方法。
教学方法:创调情境→提出问题→诱导思维→激发兴趣→分析归纳→解决问题
教学手段:实验录像、演示实验、学生实验、投影
教学过程:
[引言]通过对氧化还原反应的学习,我们了解到根据不同的分类方法可将化学反应分为不同的反应类型。如按反应物和生成物的类别以及反应前后物质种类的多少可将化学反应分为四种基本反应类型(化合、分解、置换、复分解);若根据化学反应中是否有电子转移,又可将化学反应分为氧化还原反应和非氧化还原反应。那么今天我们一起来学习另一种重要的分类方法。
[板书]第二节
[复习提问]回顾初中物质导电性实验――第一组物质是干燥的氯化钠固体、硝酸钾固体、氢氧化钠固体、磷酸固体、蔗糖固体、无水酒精,第二组是溶液、溶液、溶液、溶液、酒精溶液、蔗糖溶液
[学生回答]还记得吗?哪些物质能导电?哪些物质不能导电?干燥的固体、固体、固体、固体不导电,而溶液、溶液、溶液、溶液都能导电。蔗糖和蔗糖溶液,无水酒精及其水溶液均不导电。
[复习提问]为什么有些物质如、、、在干燥的固体时不导电,而溶于水后却能导电了呢?
[学生回答]是因为这些物质的固体中不存在自由移动的离子,而当它们溶于水后,在水分子的作用下,使这些物质电离产生了能够自由移动的阴、阳离子,从而能够导电。
[教师总结]可见酸、碱、盐的水溶液都具有导电性。
[引出新课]
[板书]一、电解质与非电解质
1.概念:
[投影](1)电解质:在水溶液里或熔化状态下能够导电的化合物叫电解质。如:、、等。
(2)非电解质:无论是在水溶液或熔化状态下都不导电的化合物叫非电解质。例:蔗糖、酒精等。
[讲述]我们已经知道酸、碱、盐是电解质,它们的水溶液都能导电。那么,我们进一步来研究在相同条件下不同种类的酸、碱、盐溶液,它们的导电能力是否相同。
[演示实验]实验1-1
[引导思考]学生认真观察实验,并对实验现象加以分析、讨论。
[学生回答]根据灯泡发光明暗程度不同,我们可以知道相同条件下,它们的导电能力不同。
[结论]电解质有强、弱之分。
[板书]二、强电解质与弱电解质
[投影]图1-10,在水中溶解和电离示意图。
[讲述]离子化合物与某些共价化合物能够在水分子作用下完全电离成离子,而某些共价化合物只能部分电离成离子。
[投影]强电解质:在水溶液里全部电离成离子的电解质。如强酸、强碱和大多数盐类。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。如。
[学生练习]写出下列物质的电离方程式;
[板书]三、:
[引导分析]由于电解质溶于水后就电离成为离子,所以电解质在水溶液中所起的反应实质上是离子之间的反应。
[板书]1.概念:离子之间的反应称为。
[学生总结]2.发生的条件:
[板书]
①生成弱电解质,如、弱酸、弱碱
②生成挥发性物质,如
③生成难溶性物质,如
[引导分析]由上述发生的条件,我们来分析的特征是什么?
[总结]3.的特征:
[投影]向着减少某些离子的方向进行,反应速率快,部分有明显的现象。
4.类型:
①离子之间交换的非氧化还原反应
如:
②离子和分子之间的非氧化还原反应
如:
③有离子参加的氧化还原反应
如:
[板书]四、方程式:
[学生实验][实验1-2]中的实验Ⅰ、Ⅱ、Ⅲ,并要求学生们仔细观察,记录现象,思考原因。
[投影]
[提问]实验现象?
[学生回答]实验Ⅰ无明显现象。
实验Ⅱ中出现白色沉淀,滤液为蓝色。
实验Ⅲ中生成不溶于稀的白色沉淀。
[引导思考]实验Ⅰ中无明显现象,原因?
[学生回答]只是溶液电离上的和与溶液电离出的的简单混和。
[引导思考]实验Ⅱ和Ⅲ中反应说明了什么?
[学生回答]实验Ⅱ和Ⅲ说明了溶液电离出的和溶液电离出的发生了化学反应生成了白色沉淀。而溶液电离出的与溶液电离出的并没有发生化学反应,在溶液中仍以和的离子形式存在。
[学生总结]实验Ⅱ中反应实质为
实验Ⅲ中反应实质为
[讲述]由以上实验Ⅱ和Ⅲ我们看出,电解质在水溶液中所电离出的离子并没有全部发生化学反应,而只有部分离子发生了化学反应生成其它物质。
[引出]1.概念:用实际参加反应的离子的符号表示的式子叫做离子方程式。
[板书]
[讲述]2.书写:(以溶液和溶液为例)
①写(化学方程式):
②离(电离):
③删(两边相同离子):
④查(质量守恒,电荷守恒)
[投影]
写出上述中和反应的方程式。
[学生回答]
[学生总结]3.离子方程式的意义:
①表示化学反应的实质。
②表示某一类反应。
[学生练习]下列离子方程式中,正确的是()
[投影]
A.把金属铁放入稀硫酸中
B.碳酸钡和稀硫酸反应
C.澄清石灰水和盐酸反应
D.向硫酸铜溶液中加入适量氢氧化钡溶液
[学生回答]选项A错在不符合反应的实际情况,因为铁与稀硫酸反应生成和,而不是和。应为:
选项B的错误是忽略了生成物是不溶性物质。应为:
选项C正确。
选项D的错误是只注意书写和反应的离子方程式,而忽略了和也反应。应为:
[总结]检查离子方程式书写是否正确时,应注意:
①两易:易溶易电离的物质以实际参加反应的离子符号表示。(弱电解质、难溶性物质、气体、单质、氧化物等用分子式表示。)
②两等:离子方程式两边的原子个数,电荷总数均应相等。
[思考题]在pH=1的溶液中,可以大量共存的离子组是()
A.
B.
C.
D.
[作业]复习课本内容
书第18页习题
 爱华网
爱华网