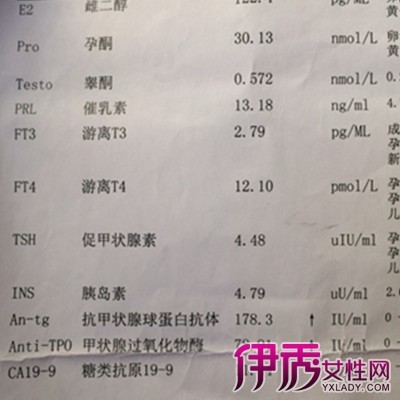
抗体(Antibody),又称免疫球蛋白(Immunoglobulin,简称 Ig),是一种由B细胞分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等的大型Y形蛋白质,仅被发现存在于脊椎动物的血液等体液中,及其B细胞的细胞膜表面。
抗体_抗体 -概念
最初有人用电泳证明血清中抗体活性在γ球蛋白部分,故曾把抗体统称为丙种(γ)球蛋白。后来发现,抗体并不都在γ区;并且位于γ区的球蛋白,也不一定都具有抗体活性。1964年,世界卫生组织举行专门会议,将具有抗体活性以及与抗体相关的球蛋白统称为免疫球蛋白(Ig),如骨髓瘤蛋白,巨球蛋白血症、冷球蛋白血症等患者血清中存在的异常免疫球蛋白以及正常人天然存在的免疫球蛋白亚单位等。因而免疫球蛋白是结构化学的概念,而抗体是生物学功能的概念。可以说,所有抗体都是免疫球蛋白,但并非所有免疫球蛋白都是抗体。
抗体_抗体 -结构
抗体是具有4条多肽链的对称结构,其中2条较长、相对分子量较大的相同的重链(H链);2条较短、相对分子量较小的相同的轻链(L链)。链间由二硫键和非共价键联结形成一个由4条多肽链构成的单体分子。轻链有κ和λ两种,重链有μ、δ、γ、ε和α五种。整个抗体分子可分为恒定区和可变区两部分。在给定的物种中,不同抗体分子的恒定区都具有相同的或几乎相同的氨基酸序列。可变区位于"Y"的两臂末端。在可变区内有一小部分氨基酸残基变化特别强烈,这些氨基酸的残基组成和排列顺序更易发生变异区域称高变区。高变区位于分子表面,最多由17个氨基酸残基构成,少则只有2――3个。高变区氨基酸序列决定了该抗体结合抗原抗原的特异性。一个抗体分子上的两个抗原结合部位是相同的,位于两臂末端称抗原结合片段(antigen-bindingfragment,Fab)。"Y"的柄部称结晶片段(crystallinefragment,FC),糖结合在FC上。抗体_抗体 -荧光抗体的鉴定
荧光抗体在使用前应加以鉴定。鉴定指医学教丨育网整理标记包括效价及荧光素与蛋白质的结合比率。抗体效价可以用琼脂双扩散法进行滴定,效价大于1:16者较为理想。荧光素与蛋白质结合比率(F/P)的测定和计算的基本方法是:将制备的荧光抗体稀释至A2801≈1.0,分别测读A280(蛋白质特异吸收峰)和标记荧光素的特异吸收峰,按公式计算。F/P值越高,说明抗体分子上结合的荧光素越多,反之则越少。一般用于固定标本的荧光抗体以F/P=1.5为宜,用于活细胞染色的以F/P=2.4为宜。
抗体工作浓度的确定方法类似ELISA间接法中酶标抗体的滴定。将荧光抗体自1:4――1:256倍比稀释,对切片标本作荧光抗体染色。以能清晰显示特异荧光、且非特异染色弱的最高稀释度为荧光抗体工作浓度。
荧光抗体的保存应注意防止抗体失活和防止荧光猝灭。最好小量分装,-20℃冻存,这样就可放置3――4年。在4℃中一般也可存放1――2年。
抗体_抗体 -分类
按作用对象
按作用对象,可将其分为抗毒素、抗菌抗体、抗病毒抗体和亲细胞抗体(能与细胞结合的免疫球蛋白,如1型变态反应中的lgE反应素抗体,能吸附在靶细胞膜上)。
按理化性质和生物学功能
按理化性质和生物学功能,可将其分为IgM、IgG、IgA、IgE、IgD五类。
抗体立体模型
IgM抗体是免疫应答中首先分泌的抗体。它们在与抗原结合后启动补体的级联反应。它们还把入侵者相互连接起来,聚成一堆便于巨噬细胞的吞噬;
IgG抗体激活补体,中和多种毒素。IgG持续的时间长,是唯一能在母亲妊娠期穿过胎盘保护胎儿的抗体。他们还从乳腺分泌进入初乳,使新生儿得到保护;
IgA抗体进入身体的黏膜表面,包括呼吸、消化、生殖等管道的黏膜,中和感染因子。还可以通过母乳的初乳把这种抗体输送到新生儿的消化道黏膜中,是在母乳中含量最多,最为重要的一类抗体;
IgE抗体的尾部与嗜碱细胞、肥大细胞的细胞膜结合。当抗体与抗原结合后,嗜碱细胞与肥大细胞释放组织胺一类物质促进炎症的发展。这也是引发速发型过敏反应的抗体;
IgD抗体的作用还不太清楚。它们主要出现在成熟的B淋巴细胞表面上,可能与B细胞的分化有关。(IgD于1995年从人骨髓瘤蛋白中发现,分子量为175kD,主要由扁桃体、脾等处浆细胞产生,人血清中IgD浓度为3――40μg/ml,不到血清总Ig的1%,在个体发育中合成较晚。IgD铰链区很长,且对蛋白酶水解敏感,因此IgD半衰期很短,仅2.8天。血清中IgD确切的免疫功能尚不清楚。在B细胞分化到成熟B细胞阶段,除了表达SmIgD,抗原刺激后表现为免疫耐受。成熟B细胞活化后或者活化后或者变成记忆B细胞时,SmIgD逐渐消失。)
按可见反应
按与抗原结合后是否出现可见反应,可将其分为:在介质参与下出现可见结合反应的完全抗体,即通常所说的抗体,以及不出现可见反应,但能阻抑抗原与其相应的完全抗体结合的不完全抗体。
按抗体来源
按抗体的来源,可将其分为天然抗体和免疫抗体。
抗体就是免疫球蛋白,是改变了的球蛋白分子。由特异性抗原刺激产生,抗体的产生是由于抗原侵入人体后引起各种免疫细胞相互作用,使淋巴细胞中的B细胞分化增殖而形成浆细胞,浆细胞可产生分泌抗体。
按抗体发展
单克隆抗体的发展经历了四个阶段,分别为:鼠源性单克隆抗体、嵌合性单克隆抗体、人源化单克隆抗体和全人源单克隆抗体。
鼠源性单克隆抗体:鼠杂交瘤单克隆抗体主要是将来源于免疫接种过的小鼠的B细胞与骨髓瘤细胞融合,继而筛选出既能无限增殖又能分泌抗体的鼠杂交融合细胞,进而进行筛选、抗体制备和抗体纯化。
嵌合性单克隆抗体:指用人的恒定区取代小鼠的恒定区,保留鼠单抗的可变区序列,形成一个人-鼠杂合的抗体。其研制程序快,可大幅度降低异源抗体的免疫原性,却几乎保持亲本鼠单抗全部的特异性和亲和力。另外,它还具有人抗体的效应功能,如补体固定、抗体依赖细胞介导的细胞毒作用(ADCC)等。
人源化单克隆抗体:利用现有的无数已详细分析过的小鼠抗体,取其与抗原直接接触的那段抗体片段(互补决定区,CDR)与人的抗体框架嫁接,经亲和力重塑,可维持其特异性和大部分的亲和力,同时几乎去除免疫原性和毒副作用。
全人源单克隆抗体:其抗体的可变区和恒定区都是人源的,去除免疫原性和毒副作用。全人源抗体制备的相关技术主要有:人杂交瘤技术、EBV转化B淋巴细胞技术、噬菌体显示技术(phagedisplay)、转基因小鼠抗体制备技术(transgenicmouse)和单个B细胞抗体制备技术等。
由人源化和全人源抗体制备的人源化和全人源抗体药物因其具有高亲和力、高特异性、毒副作用小的特点,克服了动物源抗体及嵌合抗体的各种缺点,已经成为了治疗性抗体药物发展的必然趋势。
抗体_抗体 -克隆抗体的制备
多克隆抗体的制备
抗原制备
动物免疫
血清采集与检测
多抗纯化与保存
单克隆抗体的制备
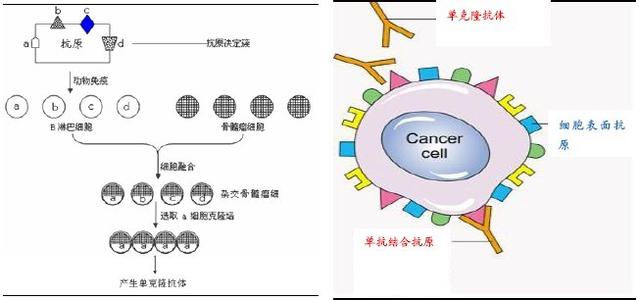
概述
B淋巴细胞在抗原的刺激下,能够分化、增殖形成具有针对这种抗原分泌特异性抗体的能力。B细胞的这种能力和量是有限的,不可能持续分化增殖下去,因此产生免疫球蛋白的能力也是极其微小的。将这种B细胞与非分泌型的骨髓瘤细胞融合形成杂交瘤细胞,再进一步克隆化,这种克隆化的杂交瘤细胞是既具有瘤细胞的无限分裂的能力,又具有产生特异性抗体的B淋巴细胞的能力。将这种克隆化的杂交瘤细胞进行培养或注入小鼠腹水内即可获得大量的高效、单一的特异性抗体。这种技术即称为单克隆抗体技术。
过程
1)免疫脾细胞的制备制备单克隆抗体的动物多采用纯系Balb/c小鼠。免疫的方法取决于所用抗原的性质。免疫方法同一般血清的制备,也可采用脾内直接免疫法。
2)骨髓瘤细胞的培养与筛选在融合前,骨髓瘤细胞应经过含8-AG的培养基筛选,防止细胞发生突变恢复HGPRT的活性(恢复HGPRT的活性的细胞不能在含8-AG的培养基中存活)。骨髓瘤细胞用10%小牛血清的培养液在细胞培养瓶中培养,融合前24h换液一次,使骨髓瘤细胞处于对数生长期。
3)细胞融合的关键:
1技术上的误差常常导致融合的失败。例如,供者淋巴细胞没有查到免疫应答。这必然要失败的。
2融合试验最大的失败原因是污染,融合成功的关键是提供一个干净的环境,以及适宜的无菌操作技术。
4)阳性克隆的筛选应尽早进行。通常在融合后10天作第一次检测,过早容易出现假阳性。检测方法应灵敏、准确、而且简便快速。具体应用的方法应根据抗原的性质,以及所需单克隆抗体的功能进行选择。常用的方法有RIA法、ELISA法和免疫荧光法等。其中ELISA法最简便,RIA法最准确。阳性克隆的筛选应进行多次,均阳性时才确定为阳性克隆进行扩增。
5)克隆化克隆化的目的是为了获得单一细胞系的群体。克隆化应尽早进行并反复筛选。这是因为初期的杂交瘤细胞是不稳定的,有丢失染色体的倾向。反复克隆化后可获得稳定的杂交瘤细胞株。
动物免疫
细胞融合
克隆筛选
交杂瘤细胞的克隆化
腹水制备与单抗纯化
关于抗体制备的详细内容参见“中国免疫学实验网”。
优化抗体:
使用Novocastra一抗制备出优质的IHC切片。经过内部开发以及拥有20年的IHC染色开发经验,这些稳定的抗体已针对自动及手动应用进行了优化。
优质
 爱华网
爱华网