氯化钠(Sodium chloride),化学式NaCl,无色立方结晶或白色结晶,其来源主要是在海水中,是食盐的主要成分,无色立方结晶或细小结晶粉末,味咸。溶于水、甘油,微溶于乙醇、液氨。不溶于盐酸。在空气中微有潮解性。氯化钠稳定性比较好,工业上用于制造纯碱和烧碱及其他化工产品,矿石冶炼,生活上可用于调味品。主要用于制造氯气、氢气、漂白粉、金属钠等工业原料,以及供盐析肥皂、鞣制皮革、食品调味和腌鱼肉蔬菜等。高度精制的用于生理盐水。若摄取过量,易得高血压。
氯化钠_氯化钠 -历史发展
氯化钠,并不是食盐,是食盐的主要成分。从古到今都一直被认可为是一种安全、无毒的调味品,符合大众口味。而且,在海中含有丰富的氯化钠,故制取成本低,所以发展起来十分轻松。
氯化钠_氯化钠 -理化性质
物理性质
熔点:
氯化钠
801°C(1074K)
沸点:1465°C(1738K)
密度:2.165克每立方厘米
折光率:1.343(1mol/L溶液在589nm)
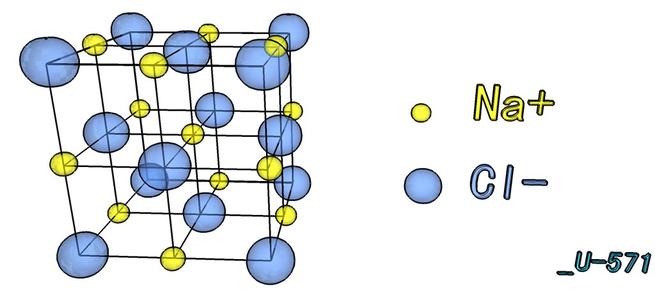
氯化钠的晶体形成立体对称。其晶体结构中,较大的氯离子排成立方最密堆积,较小的钠离子则填充氯离子之间的八面体的空隙。每个离子周围都被六个其他的离子包围着。这种结构也存在于其他很多化合物中,称为氯化钠型结构或石盐结构。
氯化钠是白色无臭结晶粉末。熔点801℃,沸点1465℃微溶于乙醇、丙醇、丁烷,在和丁烷互溶后变为等离子体,易溶于水。NaCl分散在酒精中可以形成胶体.,其水中溶解度因氯化氢存在而减少,几乎不溶于浓盐酸。无臭味咸,易潮解。易溶于水,溶于甘油,几乎不溶于乙醚。
以矿物岩盐广泛存在于自然界中。把以矿盐形式存在地下的盐水蒸发而得井盐、岩盐;将海水用阳光晒干而得海盐;将井盐、岩盐或海盐精制而得纯净氯化钠。
化学性质
氯化钠
1、制取金属钠:2NaCl=电解=2NaCl2↑
2、电解食盐水:2NaCl2H2O=电解=H2↑Cl2↑2NaOH
3、和硝酸银反应:NaClAgNO3=NaNO3AgCl↓
4、氯化钠固体中加入浓硫酸:
2NaCl+H2SO4(浓)=加热=2HCl↑+Na2SO4
NaCl+H2SO4(浓) =微热=HCl↑+NaHso4
检验方法:
1、向溶液中滴入硝酸酸化的硝酸银溶液,有白色沉淀产生。
2、用铂丝蘸取少量溶液,置于酒精灯上灼烧,火焰呈黄色,可证含有NaCl。
氯化钠_氯化钠 -主要来源
氯化钠粉末
海水和盐湖是氯化钠的主要来源,海水中约含氯化钠2.7%,有些盐湖如美国的大盐湖和约旦边境的死海中,湖水氯化钠含量高达23%。氯化钠还存在于盐湖的沉积物中,如中国班戈等湖区,氯化钠主要存于沉积物。
氯化钠_氯化钠 -制备方法
工业方法
工业盐
由海水(平均含2.4%氯化钠)引入盐田,经日晒干燥,浓缩结晶,制得粗品。亦可将海水,经蒸汽加温,砂滤器过滤,用离子交换膜电渗析法进行浓缩,得到盐水(含氯化钠160~180g/L)经蒸发析出盐卤石膏,离心分离,制得的氯化钠95%以上(水分2%)再经干燥可制得食盐。还可用岩盐、盐湖盐水为原料,经日晒干燥,制得原盐。用地下盐水和井盐为原料时,通过三效或四效蒸发浓缩,析出结晶,离心分离制得。
实验室方法
配制NaCl溶液
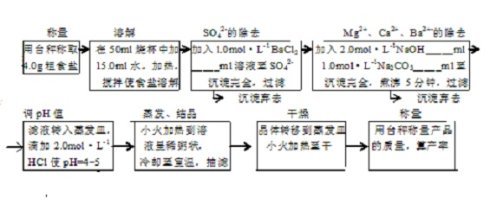
将粗盐溶于水中,去除不溶性杂质,再加精制剂如NaOH、Na2CO3和CaCl2等,使SO4、Ca、Mg、Fe等可溶性杂质变成沉淀,过滤除去,最后用纯盐酸将pH调节至7,浓缩溶液即得纯氯化钠结晶。
在实验室的制备方法是将等量的盐酸与氢氧化钠混合,生成氯化钠溶液。再把溶液蒸馏,可得氯化钠晶体。主要反应:HCl+NaOH==NaCl+H2O
常用方法
1、将粗盐溶于水中,去除不溶性杂质,再加精制剂如NaOH、Na2CO3和CaCl2等,使SO42?、Ca2+、Mg2+、Fe3+等可溶性杂质变成沉淀,过滤除去,最后用纯盐酸将PH调节至7,浓缩溶液即得纯氯化钠结晶。
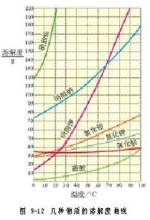
红色为氯化钠溶解度曲线
2、由海水(平均含2.4%氯化钠)引入盐田,经日晒干燥,浓缩结晶,制得粗品。
3、将海水,经蒸汽加温,砂滤器过滤,用离子交换膜电渗析法进行浓缩,得到盐水(含氯化钠160~180g/L)经蒸发析出盐卤石膏,离心分离,制得的氯化钠95%以上(水分2%)再经干燥可制得食盐(tablesalt)。
4、用岩盐、盐湖盐水为原料,经日晒干燥,制得原盐。
5、用地下盐水和井盐为原料时,通过三效或四效蒸发浓缩,析出结晶,离心分离制得。
6、在实验室的制备方法是将等量的盐酸与氢氧化钠混合,生成氯化钠溶液。再把溶液蒸馏,可得氯化钠晶体。
氯化钠_氯化钠 -储存方法
操作注意事项:密闭操作,加强通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。避免产生粉尘。避免与氧化剂接触。搬运时要轻装轻卸,防止包装及容器损坏。配备泄漏应急处理设备。倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。远离火种、热源。应与氧化剂分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
氯化钠_氯化钠 -应用领域
工业
1、电解氯化钠水溶液时,会产生氢气和氯气,氯气在化工中有很广泛的应用,可以用于合成聚氯乙烯、杀虫剂、盐酸等。
2、当斯法制取金属钠:通过电解熔融氯化钠和氯化钙的混合物制取金属钠。氯化钙用作助熔剂,可将氯化钠的熔点降低至700 °C以下。钙还原性不及钠,不会引进杂质。
3、氯化钠是许多生物学反应所必需的,如分子生物学试验中多种溶液配方都含有氯化钠,细菌培养基中大多含有氯化钠。同时也是氨碱法制纯碱时的原料。
4、无机和有机工业用作制造烧碱、氯酸盐、次氯酸盐、漂白粉的原料、冷冻系统的致冷剂,有机合成的原料和盐析药剂。钢铁工业用作热处理剂。高温热源中与氯化钾、氯化钡等配成盐浴,可作为加热介质,使温度维持在820~960℃间。此外、还用于玻璃、染料、冶金等工业。
5、分析试剂用作氟和硅酸盐微量分析试剂。
食品工业
食品业和渔业用于盐腌,还可用作调味料的原料和精制食盐。
在烹调菜肴中加入食盐可以除掉原料的一些异味,增加美味,这就是食盐的提鲜作用。“淡无味,咸无味”是说用盐量要适当,才能发挥其特有的功能。
医用
氯化钠注射液
氯化钠对于地球上的生命非常重要。大部分生物组织中含有多种盐类。血液中的钠离子浓度直接关系到体液的安全水平的调节。由信号转换导致的神经冲动的传导也是由钠离子调节的。
含氯化钠0.9%的水称为生理盐水,因为它与血浆有相同的渗透压。生理盐水是主要的体液替代物,广泛用于治疗及预防脱水,也用于静脉注射治疗及预防血量减少性休克。
人类与其他灵长类不同,人类通过出汗分泌大量的氯化钠。
氯化钠是人所不可缺少的。成人体内所含钠离子的总量约为60 g,其中 80%存在于细胞外液,即在血浆和细胞间液中。氯离子也主要存在于细胞外液。钠离子和氯离子的生理功能主要有:
(1)维持细胞外液的渗透压;
(2)参与体内酸碱平衡的调节;
(3)氯离子在体内参与胃酸的生成,此外,氯化钠在维持神经和肌肉的正常兴奋性上也有作用。
农业
其水溶液可用于选种。
按物种需要配置NaCl溶液其密度比水大种子放入NaCl溶液漂浮饱和沉下饱和也好种子而且NaCl廉价易得所选用NaCl
其他
根据新加坡科技研究属发布的新发现揭示,氯化钠可以显着提高硬盘的容量。具体来讲,现有的传统硬盘采用的是随机分配的磁片存储技术,每平方英寸只能达到0.5TB的数据密度。而新的技术得益于氯化钠的帮助,配合新的高分辨率光刻因子技术,数据数据密度将更加有序,可以达到3.3TB每平方英寸而无需复杂的设备升级。使1TB的硬盘采用这种技术,无需增加盘片就能达到6TB的容量。
氯化钠_氯化钠 -使用注意事项
危险性
危险性类别:本品不属于危险品范畴。
健康危害:食用过多容易血压升高。
燃爆危害:不易燃易爆。
急救措施
皮肤接触:皮肤接触后用清水清洗干净即可。
食入:如食用过量,应当多喝水(如:喝糖水、喝盐开水)或者使用其他措施(例如:注射生理盐水【质量分数为0.9%的氯化钠溶液】)来维持体内的盐分,否则,后果很严重(会呈人体脱水症状)。
消防措施
危险特性:本产品属于无毒性化工产品,不易燃,对消防无特殊要求。
氯化钠
有害燃烧产物:无有害燃烧产物。
泄漏应急处理
应急处理:及时更换包装袋即可。
消除方法:清扫干净,回收即可。
操作处置与储存
储存注意事项:应储存于阴凉、常温避光、通风干燥处,可以垛放,防止雨淋、不得与酸碱混存、垛底要铺放木板,用以防潮,垛放高度不超过两米。
接触控制/个体防护
呼吸系统防护:戴口罩即可。
眼睛防护:如果氯化钠晶体进入眼睛,要用大量水冲洗。
氯化钠_氯化钠 -相关新闻
烹饪误区
2012年8月12日,央视科教频道《健康之路》节目中,专家金锋称,炒菜时早放盐,可以让氯化钠的氯挥发出去,就剩下钠了。这一观点被网友认为是违反化学常识。中国农业大学食品学院营养与食品安全系副教授范志红表示,氯化钠是稳定的化合物,在烹调温度下不会分解,不可能发生氯挥发的情况。8月16日,金锋表示,在节目中的言论未经过验证,有失严谨和妥当。
新化合物
2013年12月,科研人员如今利用先进的理论理解力和极端条件,将精制食盐转化成了奇特化学物。盐由钠和氯构成。实验结果表明,在压强为20-142吉帕斯卡的条件下,NaCl可以转化为NaCl3、Na3Cl、Na2Cl、Na3Cl2和NaCl7这样的奇特化学物而且保持住了稳定的化学特性。
 爱华网
爱华网