法拉第常数(英文:constant)是近代科学研究中重要的物理常数,代表每摩尔电子所携带的电荷,符号为F,单位为C/mol。法拉第常数是阿伏伽德罗数NA=6.02214・10∧23mol∧-1与元电荷e=1.602176・10∧-19 C的积,以麦可・法拉第命名,在确定一个物质带有多少离子或者电子时该常数非常重要。一般认为法拉第常数值是96485.3383±0.0083C/mol,由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。法拉第常数以麦可・法拉第命名,说明法拉第的研究工作对这个常数的确定有决定性的意义。
法拉第常数_法拉第常数 -概念公式
1mol元电荷所具有的电量称为法拉第常数(F)
F=e×L
元电荷的电量e=1.602176×10∧-19,,阿伏伽德罗常数L=6.02214×10∧23mol∧-1
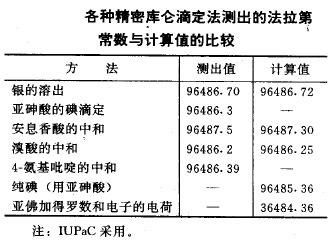
一般认为此值是96485.3383±0.0083C/mol,此值是由美国国家标准局所依据的电解实验得到的,也被认为最具有权威性。
法拉第常数_法拉第常数 -意义
在物理学和化学,尤其在电化学中法拉第常数是一个重要的常数。它是一个基本常数,其值只随其单位变化。在电解、电镀、燃料电池和电池等涉及到物质与它们的电荷的工艺中法拉第常数都是一个非常重要的常数。因此它也是一个非常重要的技术常数。
在计算每摩尔物质的能量变化时也需要法拉第常数,一个例子是计算一摩尔电子在电压变化时获得或者释放出的能量。在实际应用中法拉第常数用来计算一般的反应系数,比如将电压演算为自由能。
法拉第常数_法拉第常数 -历史
最早法拉第常数是在推导阿伏伽德罗数时通过测量电镀时的电流强度和电镀沉积下来的银的量计算出来的。
法拉第常数
 爱华网
爱华网