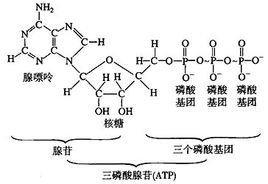
磷酸或正磷酸(H3PO4),是一种常见的无机酸,是中强酸。由五氧化二磷溶于热水中即可得到。正磷酸工业上用硫酸处理磷灰石即得。磷酸在空气中容易潮解。加热会失水得到焦磷酸,在进一步失水得到偏磷酸。磷酸主要用于制药、食品、肥料等工业,也可用作化学试剂。
磷酸_磷酸 -来源
磷酸
磷酸的原料主要是磷矿和无机酸(硫酸、盐酸或硝酸,主要为硫酸)。天然磷矿分磷灰石和磷块岩两大类,其主要成分都是氟磷酸钙〔Ca10F2(PO4)6〕。磷矿的品位和有害杂质的种类及含量,对湿法磷酸生产的技术经济影响很大,开采的磷矿一般需经过富集处理,提高其品位和排除杂质,方能满足湿法磷酸生产的要求。
磷酸_磷酸 -性质
分子结构
(一)物理性质
纯净的磷酸是无色晶体,分子式为H3PO4,高沸点酸,易溶于水。市售磷酸试剂是粘稠的、不挥发的浓溶液,磷酸含量83-98%。
(二)化学性质
磷酸是三元中强酸,分三步电离,不易挥发,不易分解,几乎没有氧化性。具有酸的通性。
与碱反应
NaOH+H3PO4=NaH2PO4+H2O;
2NaOH+H3PO4=Na2HPO4+2H2O;
3NaOH+H3PO4=Na3PO4+3H2O。
与某些盐反应
NaBr+H3PO4(浓)=NaH2PO4+HBr↑
NaI+H3PO4(浓)=NaH2PO4+HI↑
(三)磷酸根离子具有很强的配合能力,能与许多金属离子生成可溶性的配合物。如Fe与PO4可以生成无色的可溶性的配合物[Fe(PO4)2]和[Fe(HPO4)2],利用这一性质,分析化学上常用PO4掩蔽Fe离子。
(四)磷酸受强热时脱水,依次生成焦磷酸、三磷酸和多聚的偏磷酸。三磷酸是链状结构,多聚的偏磷酸是环状结构。
(五)检测:若在待测液中滴加AgNO3溶液,有黄色沉淀生成,再滴入稀HNO3,黄色沉淀溶解,则可证明原溶液中含有PO4。若待测液呈酸性,
则应先在待测液中滴氨水至中性,再滴加AgNO3溶液和稀HNO3。磷酸_磷酸 -用途
无机工业用于生产酸式磷酸锰、焦磷酸钾及各种磷酸盐类。医药工业用于制造甘油、磷酸钠、神经系统药剂)、牙料粘合剂)及青霉素的Ph调节剂等。
磷酸塑料工业用于生产酚醛树脂的缩合反应催化剂。日化工业用作生产洗涤剂的助剂,用于浸渍火柴梗,使火柴使用较为安全。冶金工业用于生产磷酸耐火泥,可提高炼钢炉寿命等。食品工业用作酸性调味剂。涂料工业用作金属防锈漆。硅平面管和集成电路生产中,普遍以铝膜作电极引线,需要对铝膜进行光刻,用磷酸作酸性清洗腐蚀剂。磷酸在水处理领域主要用作软水剂、水垢清洗剂,以及用作磷系水处理剂的生产原料等。磷酸还有许多其他用途,高纯磷酸可用于制作无氟饲料;在电镀工业中用作抛光剂;印刷工业中用作去污剂。乙烯合成与过氧化氢的精制过程中用作酸化剂;饮料生产中用作酸化剂和调味剂;染料工业中用作干燥剂。
磷酸_磷酸 -磷酸盐
磷酸盐有三类:正盐(含PO4)、磷酸一氢盐(含HPO4)、磷酸二氢盐(含H2PO)。
1、溶解性规律:正盐和一氢盐:除钾、钠、铵等少数盐外,其余都难溶于水,但能溶于强酸。二氢盐:都易溶于水。
化学反应
2、相互转化:
a、往澄清石灰水中逐滴滴加H3PO4,边滴边振荡。现象:开始有白色沉淀生成,而后逐渐溶解。
反应方程式:
3Ca(OH)2+2H3PO4=Ca3(PO4)2↓+6H2O
Ca3(PO4)2+H3PO4=3CaHPO4
CaHPO4+H3PO4=Ca(H2PO4)2
b、往磷酸溶液中逐滴滴加澄清石灰水,边滴加振荡。现象:开始无现象,当澄清石灰水滴到一定量时,有白色沉淀生成。
反应方程式:
Ca(OH)2+2H3PO4=Ca(H2PO4)2+2H2O
Ca(H2PO4)2+Ca(OH)2=2CaHPO4↓
2CaHPO4+Ca(OH)2=Ca3(PO4)2+2H2O
3、离子共存的问题
(1)H2PO4、HPO4、PO4与H不能共存
(2)H2PO4、HPO4与OH不能共存
(3)H2PO4与PO4不能共存,H2PO4+PO4=2HPO4(4)H2PO4与HPO4、HPO4与PO4可共存
磷酸_磷酸 -生产工艺
主要是用硫酸分解磷矿,然后将生成的磷酸与硫酸钙分离。其主要反应式为:
Ca10F2(PO4)6+10H2SO4+mH2O─→10CaSO4・nH2O+2HF+6H3PO4+(m-10n)H2O磷酸
为避免反应生成的硫酸钙在磷矿颗粒表面形成膜层,阻碍反应继续进行,工艺上反应过程是分成两步进行。
第一步是磷矿溶解在磷酸(由后续工序返回的一部分)中生成磷酸一钙;
第二步是硫酸与磷酸一钙反应生成磷酸和硫酸钙。
湿法生产
湿法磷酸生产工艺称为硫酸钙再结晶工艺,其过程中包含着有硫酸钙结晶水合物的转变。
发展这类工艺的目的不外乎是为了获得含P2O5浓度较高的磷酸;获得较高的收率(以P2O5计);获得含杂质少的石膏。已经实现了工业化的有三种:
①半水物-二水物一段过滤工艺。控制反应物料液相浓度为30%~32%P2O5、反应温度80~100℃,使硫酸钙先生成半水物结晶,然后温度下降为65℃左右,将结晶转化为二水物后再过滤。
②半水物-二水物两段过滤工艺。用酸分解磷矿时使石膏先生成半水物结晶,控制反应物料液相浓度为40%~50%P2O5、温度90~110℃,进行半水石膏分离,获得成品磷酸。半水石膏再转入另一个反应器水化成二水物石膏,控制反应温度为约65℃、磷酸浓度为10%~15%P2O5,进行二水物石膏分离。
③二水物-半水物两段过滤工艺。磷矿用酸分解时,使石膏先生成二水物结晶,控制温度约为65℃,用离心机分离二水石膏,获得浓度为35%~38%P2O5的成品,二水石膏转入再结晶器转化成半水石膏,控制磷酸浓度为20%~25%P2O5,硫酸浓度为约20%H2SO4,反应温度为80~100℃,分离半水石膏,滤洗液返回二水物结晶槽。
湿法磷酸的生产,仍以二水物流程为主,占世界生产能力的90%以上。原因是技术较为可靠、工艺操作条件的范围宽、设备材料的腐蚀比较容易解决和投资低等。
热法生产
热法磷酸是黄磷在空气中燃烧生成五氧化二磷,再经水化制成。
1838年,首次制成工业用的黄磷,1855~1890年间在欧洲建立了黄磷的生产厂。20世纪40~50年代,美国和德国发展了黄磷和热法磷酸的生产技术。60年代,美国曾计划大量发展黄磷和热法磷酸生产以用于肥料工业,旨在利用便宜的能源和运输黄磷比较经济的优点,后由于能源涨价,计划未能实现。热法磷酸比湿法磷酸浓度高,且产品纯,但耗电量大,价格昂贵。在水电有富余的地区,热法磷酸具有发展前途。现在除了苏联有少量用于肥料生产外,热法磷酸主要用于工业方面。1981年世界产量为3.145Mt(P2O5)。含硅高的磷矿,适宜于元素磷生产。含铁、镁和铝杂质高的磷矿用于黄磷生产时,将使电耗增加、磷收率降低。
有两种生产流程:一种是把燃烧和水化安排在同一塔内进行,液态磷从塔顶向下喷雾,空气由塔顶吸入,磷在塔中燃烧,冷的磷酸喷入塔内,使五氧化二磷进行水化反应,一部分冷的磷酸从塔顶形成膜层沿壁向下流动,以保护塔壁。从塔底部抽出热法磷酸送去冷却后返回塔顶。另一种是把燃烧和水化分开在两个塔内进行,在塔的外壁大量喷水以移除反应热。
多磷酸生产
生产方法有热法和湿法两种。热法多磷酸生产只需在热法磷酸的生产过程中强化冷却系统,使五氧化二磷在少量水的情况下水化即可。湿法多磷酸生产是将浓度为52%~54%P2O5的磷酸进一步脱水。有三种脱水工艺:浸没燃烧脱水;膜式蒸发脱水;强制循环真空蒸发脱水。
磷酸_磷酸 -安全性
危害性
对健康的危害:
蒸气或雾对眼、鼻、喉有刺激性。
口服液体可引起恶心、呕吐、腹痛、血便或体克。皮肤或眼接触可致灼伤。
毒性:属低毒类。
急性毒性:LD501530mg/kg(大鼠经口);2740mg/kg(兔经皮)
刺激性:兔经皮595mg/24小时,严重刺激;兔眼119mg严重刺激。慢性影响:鼻粘膜萎缩、鼻中隔穿孔。长期反复皮肤接触,可引起皮肤刺激。
泄漏应急处理
疏散泄漏污染区人员至安全区,禁止无关人员进入污染区,建议应急处理人员戴好防毒面具,穿化学防护服。不要直接接触泄漏物,用沙土、干燥石灰或苏打灰混合,然后收集转移到安全场所或以少量加入大量水中,调节至中性,再放入废水系统。如大量泄漏,收集回收或无害处理后废弃。
废弃物处置方法:建议把废料缓慢地加到碱液-石灰水中,搅拌后,用大量水冲入下水道。
防护措施
呼吸系统防护:空气中浓度超标时,必须佩带防毒面具或供气式头盔。紧急事态抢救或逃生时,建议佩带自给式呼吸器。
眼睛防护:戴化学安全防护眼镜。
防护服:穿工作服(防腐材料制作)。
手防护:戴橡皮手套。
其它:工作后,淋浴更衣。单独存放被毒物污染的衣服,洗后再用。保持良好的卫生习惯。
急救措施
皮肤接触:脱去污染的衣着,立即用流动清水彻底冲洗。若有灼伤,按酸灼伤处理。
眼睛接触:立即提起眼睑,用流动清水或生理盐水冲洗至少15分钟。就医。
吸入:脱离现场至空气新鲜处。必要时进行人工呼吸。就医。
食入:误服者立即漱口,给饮牛奶或蛋清。就医。
灭火方法:泡沫、二氧化碳、砂土、干粉。
磷酸_磷酸 -其他
磷酸盐调料
根据美国食品化学药碘(FCC)磷酸盐在食品工业中的功能可分为15类:
1、酸味剂:磷酸
2、抗结块剂:磷酸钙
3、抗氧化剂:次磷酸钙
4、缓冲剂:磷酸氢二铵、磷酸二氢铵、磷酸氢钙、磷酸钙、焦磷酸钙、磷酸二氢钾、磷酸氢二钾、酸式焦磷酸钠、磷酸二氢钠、磷酸氢二钠、磷酸钠、焦磷酸钠
5、面团改良剂:磷酸氢二铵、磷酸二氢铵、磷酸二氢钙、磷酸氢钙
6、乳化剂:磷酸钾、聚偏磷酸钾、焦磷酸钾、磷酸铝钠(碱性)、偏磷酸钠(不溶性)、磷酸二氢钠、磷酸氢二钠、聚磷酸钠(玻璃质)、焦磷酸钠
7、硬化剂:磷酸二氢钙
8、保湿剂:聚偏磷酸钾
9、发酵剂:磷酸氢二铵、磷酸二氢铵、酸式焦磷酸钠、磷酸铝钠(酸性)
10、营养剂:磷酸二氢钙、磷酸氢钙、磷酸钙、焦磷酸钙、磷酸铁、焦磷酸铁、磷酸氢镁、磷酸镁、次磷酸锰、焦磷酸铁钠、磷酸二氢钠、磷酸氢二钠、磷酸钠、焦磷酸钠
11、防腐剂:次磷酸钠。
12、螯合剂:磷酸二氢钙、磷酸、磷酸二氢钾、磷酸氢二钾、酸式焦磷酸钠、偏磷酸钠(不溶性),聚磷酸钠(玻璃状)。
13、改良淀粉添加剂:三偏焦磷酸、磷酸二氢钾。
14、组织改良剂:焦磷酸钾、三聚磷酸钾、偏磷酸钠(不溶性)、磷酸氢二钠(玻璃质)、三聚磷酸钠。
15、发酵食品:磷酸二氢铵、磷酸氢二铵、磷酸二氢钙、磷酸二氢钙、磷酸二氢钾、磷酸氢二钾。
由上可看出:磷酸盐在食品加工中的功能主要有两点,一是品质改良剂,二是营养强化剂。
磷酸_磷酸 -磷酸的危害
蒸气或雾对眼、鼻、喉有刺激性。口服液体可引起恶心、呕吐、腹痛、血便或休克。皮肤或眼接触可致灼伤。慢性影响:鼻粘膜萎缩、鼻中隔穿孔。长期反复皮肤接触,可引起皮肤刺激。
磷酸中毒后如何急救
1、皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。尽快就医。
2、眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。尽快就医。
3、吸入:迅速脱离现场至空气新鲜处,保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。尽快就医。
4、食入:误服者立即漱口,给饮牛奶或蛋清。尽快就医。
如何安全防范
密闭操作,注意通风。尽可能机械化、自动化。提供安全淋浴和洗眼设备。可能接触其蒸气时,必须佩戴自吸过滤式防毒面具(半面罩),可能接触其粉尘时,建议佩戴自吸过滤式防尘口罩。戴化学安全防护眼镜,穿胶布耐酸碱服,戴橡胶耐酸碱手套。工作现场禁止吸烟、进食和饮水,饭前要洗手。工作毕,淋浴更衣。单独存放被毒物污染的衣服,洗后备用。保持良好的卫生习惯。
 爱华网
爱华网