nitrate 硝酸HNO3形成的盐类。由金属离子(铵离子)和硝酸根离子组成的化合物,重要的有:硝酸钠、硝酸钾、硝酸铵、硝酸钙、硝酸铅、硝酸铈等。硝酸盐是由金属离子(包括铵根离子)和硝酸根离子组成的化合物,重要的有硝酸铵,硝酸钾,硝酸钠,硝酸钙等。比如农家常说的铵肥,主要成分就是硝酸铵。
硝酸盐_硝酸盐 -定义
由金属离子或铵根离子与硝酸根离子组成的盐类。
硝酸盐_硝酸盐 -概述
硝酸盐nitrate由硝酸衍生的化合物的总称。硝酸盐是离子化合物,含有硝酸根离子NO3-。和另一正离子,如硝酸铵中的NH4+离子。
nitrate硝酸HNO3的盐类。由金属离子和硝酸根离子组成的化合物,重要的有:硝酸钠、硝酸钾、硝酸铵、硝酸钙、硝酸铅、硝酸铈等。如:AgNO3(银离子和硝酸根离子),Zn(NO3)2(锌离子和硝酸根离子)……都是硝酸盐。NaNO3(钠离子和硝酸根离子)只是“硝酸盐”的一种。硝酸盐几乎全部易溶于水,只有硝酸脲微溶于水,碱式硝酸铋难溶于水,所以溶液中硝酸根不能被其他绝大多数阳离子沉淀。硝酸盐大量存在于自然界中,主要来源是固氮菌固氮形成,或在闪电的高温下空气中的氮气与氧气直接化合成氮氧化物,溶于雨水形成硝酸,在与地面的矿物反应生成硝酸盐。固体的硝酸盐加热时能分解放出氧,其中最活泼的金属的硝酸盐仅放出一部分氧而变成亚硝酸盐,其余大部分金属的硝酸盐,分解为金属的氧化物、氧和二氧化氮。硝酸盐在高温或酸性水溶液中是强氧化剂,但在碱性或中性的水溶液几乎没有氧化作用。主要用途是供植物吸收的氮肥,氮元素不仅是氨基酸与蛋白质的主要成分,还可以合成叶绿素,促进光合作用,所以如果植物缺氮就会叶子枯黄。硝酸钠和硝酸钙是很好的氮肥。硝酸钾是制黑色火药的原料。硝酸铵可作肥料,也可制炸药。由硝酸作用于相应的金属或金属氧化物等而制得。
硝酸盐试纸
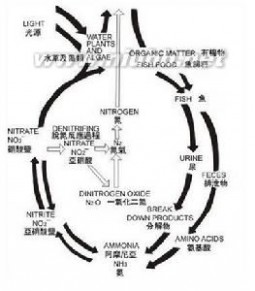
无公害蔬菜硝酸盐的含量应控制在一定范围内。因此在栽培上施肥应围绕着降低硝酸盐含量而进行,故巧施肥是无公害蔬菜生产的关键,在施肥过程中应掌握以下的技巧。一是重施有机肥有机肥不会导致蔬菜硝酸盐污染,耐贮存,品质好。但用于蔬菜的有机肥应充分腐熟。沼液是无害化优质肥料,经常施用病虫少,可减少农药用量,提高蔬菜产量,能生产出最佳的无公害蔬菜。二是不施硝态氮蔬菜施用硝酸铵、硝酸钙和硝酸钾等硝酸肥,容易使蔬菜积累硝酸盐。而施用碳铵、硫酸铵、和尿素等肥料,应控制用量,并深施盖土,可减少蔬菜对硝酸盐的积累。三是因季节施肥夏秋季气温高,不利于积累硝酸盐,可适量地施氮肥。冬春季气温低,光照弱,硝酸盐还原酶活性下降,容易累硝酸盐,应不施或少施氮肥。四是因地施肥肥力高,富含有机腐植质的土壤,蔬菜易积累硝酸盐,宜禁施氮肥。低肥菜地,蔬菜积累的硝酸盐较轻,可施氮肥和有机肥以培肥地力。五是早施苗肥苗期施氮肥较好,有利于蔬菜早发、快长,降低硝酸盐含量。六是控制氮肥用量蔬菜中硝酸盐的积累随着施肥量的增加而提高。因此,每667平方米施氮量应控制在纯氮15公斤内,2/3作基肥,1/3作苗肥深施。七是叶菜不施尿素叶面肥叶面施氮肥使其直接与空气接触,铵离子易变成硝酸根离子被叶子吸收,硝酸盐积累增加,因此叶菜不宜施尿素叶面肥。八是控制废水、污水淋灌废水、污水含大量重金属离子、毒物、病菌和虫卵等,直接污染蔬菜无公害蔬菜的施肥。
硝酸盐_硝酸盐 -种类
1.硝酸钾
别名:土硝:硝石、火硝;分子式:KNO3;分子量:101.11。
性状:白色透明斜方晶系或菱形系结晶体或者白色粉末。无嗅无毒,味咸辣有清凉感。空气中不潮解,易溶于水、液氨、甘油,不溶于无水乙醇与乙醚。硝酸钾是强氧化剂,与易燃物、有机物等接触能引起燃烧爆炸,并发生有毒和刺激性气体,与炭或硫一起加热时,能发强光而燃烧。
制作方法:硝酸钾可采用转化法、硝石法和吸收法制作生产。
应用范围:医药工业用于生产青霉素钾盐等药剂;机械工业用于热处理时淬火之盐浴;化学工业用于制造黑色炸药;农业上用作农作物的氮钾肥料。此外,在火柴、陶瓷、玻璃、矿业等生产活动中,也都需要硝酸钾。
包装及储运:一般用50千克内衬塑料袋,外套编织袋包装。属于一级无机氧化剂,危规编号为21027。应储存于干燥的库房中,不可与有机物、还原剂及易燃物(硫、磷、木炭等)共储混运。搬运时应轻拿轻放,防止包装破损。
2.硝酸银
分子式:AgN03;分子量:169.87。
性状:无色透明斜方片状晶体,味苦,干燥空气中稳定,在有机物存在下易还原为黑色金属银。硝酸银在氨的水溶液中遇葡萄糖、甲醛等,能还原生成“银镜”,故称“银镜反应”。
制作方法:由金属银与硝酸直接反应制得。
应用范围:用于制造照相底片和电影胶片的感光材料;用于保温瓶胆及镜子镀银、电子元件的镀银以增加导电性能;医药上用作杀菌剂、腐蚀剂、日化工业用于染毛发等。
包装储运:使用l千克深棕色大口玻璃瓶装,外套木箱包装。应储存于通风阴凉干燥的库房内,以免露光和潮解。不可与有机物共储混运。失火时可用水或二氧化碳灭火机扑救。
硝酸盐_硝酸盐 -合成
硝酸盐试纸硝酸与金属、金属氧化物或碳酸盐反应是最简单的制备硝酸盐的方法。某些含水的硝酸盐如 Be(NO3)2,Mg(NO3)2和 Cu(NO3)2加热水解 ,因此得不到相应的无水硝酸盐。无水硝酸盐可通过下列途径制得:
在液态 N2O4中反应:
Ni(CO)4+ N2O4→ Ni(NO3)2+ 2NO + 4CO
在纯 HNO3-N2O5或液态 N2O5中反应:
TiCl4+ 4N2O5→ Ti(NO3)4+ 2N2O4+ 2Cl2
与卤素的硝酸盐在低温反应。如硝酸氯 ClNO3:
TiCl4+ 4ClNO3?(-80℃)→ Ti(NO3)4+ 2Cl2
某些金属还可形成通式为 MOx(NO3)y的碱式硝酸盐,如 BiO(NO3)2。
大多数硝酸盐为离子型晶体,易溶于水。某些无水盐具有挥发性。
硝酸盐_硝酸盐 -结构
硝酸根离子具有以下共振式:共振式
硝酸根离子,其中氮氧键介于单双键之间。
硝酸盐_硝酸盐 -分解
硝酸根离子的静电势能图,可以看出氧原子聚集了大部分的负电荷。硝酸盐分解的产物可以是:
亚硝酸盐和氧气(碱金属和碱土金属的硝酸盐);
金属氧化物和氮氧化物(镁和铜之间的硝酸盐);
金属单质(铜后金属硝酸盐)。
硝酸盐_硝酸盐 -配位化合物
硝酸根和金属离子可以按多种方式配位,包括单齿、双齿、叁齿或端梢、桥式等。
硝酸盐_硝酸盐 -检验
在强菌作用下,腐烂蔬菜中的硝酸盐还原硝酸根离子可在酸性介质中,通过和铁(II)反应产生棕色环加以定性检出。参见棕色环实验。
总反应为:
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
虽然该反应已有很久的历史,但其机理却是不久前经分光光度法及电位滴定法的系统研究后才弄清楚的:[2]
Fe2+ + NO3- + 2H+ → Fe3+ + NO2+ H2O
Fe2+ + NO2+ H+ → Fe3+ + HNO2
Fe2+ + HNO2+ H+ → Fe3+ + NO + H2O
Fe2+ + NO → FeNO2+
2NO2+ H2O → HNO2+ NO3- + H+
2HNO2→ NO + NO2+ H2O
NO + NO3- + H+ → NO2+ HNO2
其中棕色环是由 FeNO2+(第四步)引起的,速控步则是最后一步。
硝酸盐_硝酸盐 -危害
香肠、火腿、腊肉等加有硝酸盐硝酸盐(NO3―)与亚硝酸盐(NO2―)分别是硝酸(HNO3)和亚硝酸(HNO2)的酸根,它们作为环境污染物而广泛地存在于自然界中,尤其是在气态水、地表水和地下水中以及动植物体与食品内。
环境中硝酸盐与亚硝酸盐的污染来源很多,如:
1.人工化肥:有硝酸铵、硝酸钙、硝酸钾、硝酸钠和尿素等;
2.生活污水、生活垃圾与人畜粪便,据测试1升生活污水在自然降解过程中,可产生110毫克硝酸盐;1公斤垃圾粪便堆肥在自然条件下经淋滤分解后,可产生492毫克硝酸盐;
3.食品、燃料、炼油等工厂排出大量的含氨废弃物,经过生物、化学转换后均形成硝酸盐进入环境中;
4.汽车、火车、轮船、飞机、锅炉、民用炉等燃烧石油类燃料、煤炭、天然气,可产生大量氮氧化物,平均燃烧1吨煤、1千升油和1万立方米天然气可分别产生二氧化氮气体9、13与63公斤,这些二氧化氮气体经降水淋溶后可形成硝酸盐降落到地面和水体中;
5.食品防腐与保鲜:硝酸盐与亚硝酸盐被广泛用在肉品和鱼的防腐和保存上,以使肉制品呈现红色和香味,在每公斤肉食品中加入亚硝酸盐(一般为亚硝酸钠)5毫克以下,在一定时间内肉色观感良好;加入20毫克以上,可呈现商业上需要的稳定色彩;加入50毫克则有特殊气味。
环境中化肥施用、污水灌溉、垃圾粪便、工业含氮废弃物、燃料燃烧排放的含氮废气等在自然条件下,经降水淋溶分解后形成硝酸盐,流入河、湖并渗入地下,从而造成地表水和地下水的硝酸盐污染。如污水下渗、污灌和滥施化肥可使地下水硝酸盐含量由数毫克/升剧增至400毫克/升以上(国家生活饮用水硝酸盐含量卫生标准小于88.6毫克/升,以氮计小于20毫克/升);滥施化肥、污灌、用硝酸盐污染的水源灌溉也使农作物吸收了大量的硝酸盐类,如过分施肥所产的菠菜中每公斤干重可含亚硝酸盐达3600毫克。还有腌制的渍酸菜、经过长途运输和长期贮存的蔬菜以及隔夜的熟蔬菜不仅硝酸盐含量大量增加,而且在硝酸盐还原菌的作用下,硝酸盐被还原为亚硝酸盐。
上述含有大量硝酸盐与亚硝酸盐的饮水、蔬菜、粮食、鱼、肉制品、渍酸菜、隔夜炒菜等经人食用后,大量亚硝酸盐可使人直接中毒,而且硝酸盐在人体内也可被还原为亚硝酸盐。亚硝酸盐与人体血液作用,形成高铁血红蛋白,从而使血液失去携氧功能,使人缺氧中毒,轻者头昏、心悸、呕吐、口唇青紫,重者神志不清、抽搐、呼吸急促,抢救不及时可危及生命。不仅如此,亚硝酸盐在人体内外与仲胺类作用形成亚硝胺类,它在人体内达到一定剂量时是致癌、致畸、致突变的物质,可严重危害人体健康。为了防止硝酸盐与亚硝酸盐的危害,除了要科学合理地施用化肥、禁止使用污水灌溉、实行污水、垃圾与粪便无害化处理等环保措施以保护地表水与地下水源不遭受硝酸盐和亚硝酸盐污染外,还应尽量少吃腌制、熏制、腊制的鱼、肉类、香肠、腊肉、火腿、罐头食品、渍酸菜、盐腌不久的菜;不买存放过久、隔日或发蔫的蔬菜;当日买的菜当日吃完;不吃隔夜的熟蔬菜;不可将剩饭菜长久存放;不可将工业用亚硝酸盐(如亚硝酸钠)当做食盐误食。
硝酸盐_硝酸盐 -去除器
硝酸盐去除器水族箱水质中所包含的硝酸盐(NO3)应该不具毒性的的,但是硝酸盐是水族箱的“隐形杀手”。硝酸盐去除器是利用水质处理细菌去除水族箱水质中硝酸盐的一种过滤设备,可以充分利用水质处理细菌的作用将水质中硝酸盐还原,将硝酸盐含量降低于50mg/L,甚至更低的无害等级。工作原理是利用一种水质处理细菌将硝酸盐作为它代谢中的需氧物质,NO3最终代谢成为N2和CO2。氧被运用于代谢过程中。则被排入N2 大气中,代谢的生成物为CO2。
在硝酸盐去除器内部填充着大量生物过滤球,为了避免底部积水造成滞留区,由动力马达将水不断从容器底部抽到顶端,然后又喷淋于生物过滤球的表面,如此再流回底部始终保持生物过滤球的湿润状态。生物过滤球表面附著生长的水质处理细菌会不断吸收容器内部的氧气分裂繁殖,一旦容器中的氧气耗尽,它们就吸收NO3离子中的,并NO3将还原成为NO2,并在最终再将NO2中的氧全部吸收,还原为N2排入大气中。
整个过程中,水流的氧化还原电流自正极转向负极不断地下降,可以通过氧化还原电位确定硝酸盐去除的程度。基于硝酸盐去除器中的水是在没有溶氧的情况下被还原成为氮,还原反应是主导的,因此氧化还原的电流很低,通常在-50mv-250mv。氧化还原的电流高于- 50mv的时候,硝酸盐去除的反应停留在硝酸盐阶段,如果氧化还原的电流低于-300mv的时候,硝酸盐则已经全部被还原,于是这些水质处理细菌就会汲取硝酸盐的氧产生HS。所以当氧化还原电位指示其电流不到-50mv或呈正极的时候,就要控制水族箱中的水继续流入硝酸盐去除器中。当氧化还原电位指示其电流低于-300mv的时候,就需要增加水族箱的水进入硝酸盐去除器。
只有密切注意硝酸盐去除器的氧化还原电位的变化才能够保证硝酸盐去除的正常进行。
 爱华网
爱华网