氨(Ammonia,即阿摩尼亚),或称“氨气”,氮和氢的化合物,分子式为NH?,是一种无色气体,有强烈的刺激气味。极易溶于水,常温常压下1体积水可溶解700倍体积氨,水溶液又称氨水。降温加压可变成液体,液氨是一种制冷剂。氨也是制造硝酸、化肥、炸药的重要原料。氨对地球上的生物相当重要,它是许多食物和肥料的重要成分。氨也是所有药物直接或间接的组成。氨有很广泛的用途,同时它还具有腐蚀性等危险性质。由于氨有广泛的用途,氨是世界上产量最多的无机化合物之一,多于八成的氨被用于制作化肥。由于氨可以提供孤对电子,所以它也是一种路易斯碱。
氨_氨 -简介
氨
氨:[ān][ㄢˉ] (铵根离子:NH?+)
郑码:MYWZ,U:6C28,GBK:B0B1
半包围结构笔顺编号:3115445531
参考词汇:
英文:ammonia (阿摩尼亚)
化学式:NH?
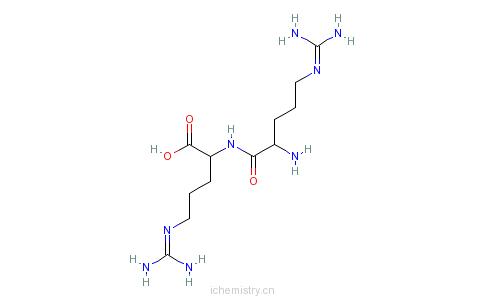
电子式:如右图
三维模型
一、结构:氨分子为三角锥形分子,是极性分子。N原子以sp3杂化轨道成键。
二、物理性质:氨气通常情况下是有刺激性气味的无色气体,密度比空气小,极易溶于水,易液化
,液氨可作制冷剂。以700:1的溶解度溶于水。
摩尔质量:17.0306g/mol CAS: 7664-41-7
密度: 0.638567 (标况)
熔点(mp):-77.73 ℃
沸点(bp):-33.34 ℃
临界点:132.9°C,11.38MPa
25%~28%浓氨水密度:0.899 g/mL,0 ℃
爆炸极限:15.8%~28%
偶极距:1.42 D
氨_氨 -分子结构
电子式
氮原子有5个价电子,其中有3个未成对,当它与氢原子化合时,每个氮原子可以和3个氢原子通过极性共价键结合成氨分子,氨分子里的氮原子还有一个孤对电子。氨分子的空间结构是三角锥型,极性分子。
氨_氨 -理化性质
化学性质
1、NH?(挥发性)遇HCl(挥发性)气体有白烟产生,可与氯气反应。
2、氨水(一水合氨,NH3・H2O)可腐蚀许多金属,尤其铜,氨区内一般要求不准用铜材质设备,一般若用铁桶装氨水,铁桶应内涂沥青。
3、氨的催化氧化是放热反应,产物是NO,是工业制硝酸的重要反应,NH?也可以被氧化成N?。
4、NH?能使湿润的红色石蕊试纸变蓝。
在水中产生少量氢氧根离子,呈弱碱性.
⒌氨与酸反应生成铵盐:NH?+HCI=NH?CI
氨在英文中有时会被称作anhydrousammonia(译为无水氨),以和在英文中与它名称类似的氨水区别。中文中很少有人会把氨气和氨水混为一谈。
氨气溶于水得到氨水,氨水的主要成分是一水合氨,但是不能认为一水合氨就是氨水。而且氨水成碱性的原因就是一水合氨在水中电离出氢氧根离子。市售氨水浓度为25%-28%。
NH?・H?O?NH?++OH-其性质和氨气完全不一样。实验室的稀氨水一的浓度一般为1M至2M。氨的饱和水溶液(大约18M)的密度是0.880gcm,故可称之为.880Ammonia。
化学反应(1)跟水反应
氨在水中的反应可表示为:NH3+H2O=NH3・H2O
一水合氨不稳定受热分解生成氨和水
氨水在中学化学实验中三应用
①用蘸有浓氨水的玻璃棒检验HCl等气体的存在
②实验室用它与铝盐溶液反应制氢氧化铝
③配制银氨溶液检验有机物分子中醛基的存在。
(2)跟酸反应
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+HCl===NH4Cl
3NH3+H3PO4===(NH4)3PO4
NH3+CH3COOH===CH3COONH4
NH3+CO2+H2O===NH4HCO3
(3)在纯氧中燃烧
4NH3+3O2==点燃==2N2+6H2O
(4)催化氧化
4NH3+5O2=催化剂加热=4NO+6H2O
该反应是放热反应,是工业制硝酸的第一步。
(5)与碳的反应
NH3+C=加热=HCN+H2↑(剧毒氰化氢)
(6)液氨的自偶电离
液氨的自偶电离为:
2NH3==(可逆)NH2+NH4K=1.9×10^-30(223K)
(7)取代反应
取代反应的一种形式是氨分子中的氢被其他原子或基团所取代,生成一系列氨的衍生物。另一种形式是氨以它的氨基或亚氨基取代其他化合物中的原子或基团,例如:
COCl2+4NH3==CO(NH2)2+2NH4Cl
HgCl2+2NH3==Hg(NH2)Cl+NH4Cl
这种反应与水解反应相类似,实际上是氨参与的复分解反应,故称为氨解反应。
(8)与水、二氧化碳
NH3+H2O+CO2==NH4HCO3
此反应可逆,碳酸氢铵受热会分解
NH4HCO3=(加热)=NH3+CO2+H2O
(9)与氧化物反应
3CuO+2NH3==加热==3Cu+3H2O+N2
这是一个氧化还原反应,采用氨气与氧化铜共热,体现了氨气的还原性。
(10)氨水(NH3・H2O)对大部分物质没有腐蚀性,但可腐蚀许多金属,在有水汽存在的条件下对铜、银等金属有腐蚀性,一般若用铁桶装氨水,铁桶应内涂沥青。
(11)NH3能使湿润的紫色石蕊试纸变蓝。电离方程式在水中产生少量氢氧根离子,呈弱碱性。
物理性质
(1)有刺激性气味的气体
氨对人体的眼、鼻、喉等有刺激作用,吸入大量氨气能造成短时间鼻塞,并造成窒息感,眼部接触以造成流泪,接触时应小心。如果不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
(2)密度小
氨气的密度为0.771g/L(标准状况下)
(3)沸点较高
氨很容易液化,在常压下冷却至-33.5℃或在常温下加压至700KPa至800KPa,气态氨就液化成无色液体,同时放出大量的热。液态氨汽化时要吸收大量的热,使周围物质的温度急剧下降,所以氨常作为制冷剂。以前一些老式冰棍就是利用氨气制作的
(4)易溶于水
氨极易溶于水,在常温、常压下,1体积水能溶解约700体积的氨。
氨_氨 -主要用途
氨用于制造氨水、氮肥(尿素、碳铵等)、复合肥料、硝酸、铵盐、纯碱等,广泛应用于化工、轻工、化肥、制药、合成纤维等领域。含氮无机盐及有机物中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等都需直接以氨为原料。此外,液氨常用作制冷剂,氨还可以作为生物燃料来提供能源。
氨_氨 -主要制法
合成氨的工艺流程
⑴原料气制备 将煤和天然气等原料制成含氢和氮的粗原料气。对于固体原料煤和焦炭,通常采用气化的方法制取合成气;渣油可采用非催化部分氧化的方法获得合成气;对气态烃类和石脑油,工业中利用二段蒸汽转化法制取合成气。
⑵净化 对粗原料气进行净化处理,除去氢气和氮气以外的杂质,主要包括变换过程、脱硫脱碳过程以及气体精制过程。
①一氧化碳变换过程
在合成氨生产中,各种方法制取的原料气都含有CO,其体积分数一般为12%~40%。合成氨需要的两种组分是H?和N?,因此需要除去合成气中的CO。变换反应如下:
CO+H?O→H?+CO? ΔH =-41.2kJ/mol
由于CO变换过程是强放热过程,必须分段进行以利于回收反应热,并控制变换段出口残余CO含量。第一步是高温变换,使大部分CO转变为CO?和H?;第二步是低温变换,将CO含量降至0.3%左右。因此,CO变换反应既是原料气制造的继续,又是净化的过程,为后续脱碳过程创造条件。
②脱硫脱碳过程
各种原料制取的粗原料气,都含有一些硫和碳的氧化物,为了防止合成氨生产过程催化剂的中毒,必须在氨合成工序前加以脱除,以天然气为原料的蒸汽转化法,第一道工序是脱硫,用以保护转化催化剂,以重油和煤为原料的部分氧化法,根据一氧化碳变换是否采用耐硫的催化剂而确定脱硫的位置。工业脱硫方法种类很多,通常是采用物理或化学吸收的方法,常用的有低温甲醇洗法(Rectisol)、聚乙二醇二甲醚法(Selexol)等。
粗原料气经CO变换以后,变换气中除H?外,还有CO?、CO和CH?等组分,其中以CO?含量最多。CO?既是氨合成催化剂的毒物,又是制造尿素、碳酸氢铵等氮肥的重要原料。因此变换气中CO?的脱除必须兼顾这两方面的要求。
一般采用溶液吸收法脱除CO?。根据吸收剂性能的不同,可分为两大类。一类是物理吸收法,如低温甲醇洗法(Rectisol),聚乙二醇二甲醚法(Selexol),碳酸丙烯酯法。一类是化学吸收法,如热钾碱法,低热耗本菲尔法,活化MDEA法,MEA法等。4
③气体精制过程
经CO变换和CO?脱除后的原料气中尚含有少量残余的CO和CO?。为了防止对氨合成催化剂的毒害,规定CO和CO?总含量不得大于10cm3/m3(体积分数)。因此,原料气在进入合成工序前,必须进行原料气的最终净化,即精制过程。
目前在工业生产中,最终净化方法分为深冷分离法和甲烷化法。深冷分离法主要是液氮洗法,是在深度冷冻(
CO+3H?→CH?+H?O ΔH=-206.2kJ/mol
CO?+4H?→CH?+2H?O ΔH=-165.1kJ/mol
⑶氨合成 将纯净的氢、氮混合气压缩到高压,在催化剂的作用下合成氨。氨的合成是提供液氨产品的工序,是整个合成氨生产过程的核心部分。氨合成反应在较高压力和催化剂存在的条件下进行,由于反应后气体中氨含量不高,一般只有10%~20%,故采用未反应氢氮气循环的流程。氨合成反应式如下:
N?+3H?→2NH?(g) ΔH=-92.4kJ/mol
合成氨的催化机理
热力学计算表明,低温、高压对合成氨反应是有利的,但无催化剂时,反应的活化能很高,反应几乎不发生。当采用铁催化剂时,由于改变了反应历程,降低了反应的活化能,使反应以显着的速率进行。格哈德・埃特尔在哈伯研究所证实了H?和N?在固体催化剂表面合成氨的反应过程:首先是氮分子在铁催化剂表面上进行化学吸附,使氮原子间的化学键减弱。接着是化学吸附的氢原子不断地跟表面上的氮分子作用,在催化剂表面上逐步生成―NH、―NH?和NH?,最后氨分子在表面上脱吸而生成气态的氨。上述反应途径可简单地表示为:
xFe + N?→FexN
FexN +〔H〕吸→FexNH
FexNH +〔H〕吸→FexNH?
FexNH? +〔H〕吸FexNH?→xFe+NH?
在无催化剂时,氨的合成反应的活化能很高,大约335kJ/mol。加入铁催化剂后,反应以生成氮化物和氮氢化物两个阶段进行。第一阶段的反应活化能为126kJ/mol~167kJ/mol,第二阶段的反应活化能为13kJ/mol。由于反应途径的改变(生成不稳定的中间化合物),降低了反应的活化能,因而反应速率加快了。
催化剂的中毒
催化剂的催化能力一般称为催化活性。有人认为:由于催化剂在反应前后的化学性质和质量不变,一旦制成一批催化剂之后,便可以永远使用下去。实际上许多催化剂在使用过程中,其活性从小到大,逐渐达到正常水平,这就是催化剂的成熟期。接着,催化剂活性在一段时间里保持稳定,然后再下降,一直到衰老而不能再使用。活性保持稳定的时间即为催化剂的寿命,其长短因催化剂的制备方法和使用条件而异。
催化剂在稳定活性期间,往往因接触少量的杂质而使活性明显下降甚至被破坏,这种现象称为催化剂的中毒。一般认为是由于催化剂表面的活性中心被杂质占据而引起中毒。中毒分为暂时性中毒和永久性中毒两种。例如,对于合成氨反应中的铁催化剂,O?、CO、CO?和水蒸气等都能使催化剂中毒。但利用纯净的氢、氮混合气体通过中毒的催化剂时,催化剂的活性又能恢复,因此这种中毒是暂时性中毒。相反,含P、S、As的化合物则可使铁催化剂永久性中毒。催化剂中毒后,往往完全失去活性,这时即使再用纯净的氢、氮混合气体处理,活性也很难恢复。催化剂中毒会严重影响生产的正常进行。工业上为了防止催化剂中毒,要把反应物原料加以净化,以除去毒物,这样就要增加设备,提高成本。因此,研制具有较强抗毒能力的新型催化剂,是一个重要的课题。
中国合成氨工业的发展情况
解放前中国只有两家规模不大的合成氨厂,解放后合成氨工业有了迅速发展。1949年全国氮肥产量仅0.6万吨,而1982年达到1021.9万吨,成为世界上产量最高的国家之一。
近几年来,中国引进了一批年产30万吨氮肥的大型化肥厂设备。中国自行设计和建造的上海吴泾化工厂也是年产30万吨氮肥的大型化肥厂。这些化肥厂以天然气、石油、炼油气等为原料,生产中能量损耗低、产量高,技术和设备都很先进。
化学模拟生物固氮的研究
目前,化学模拟生物固氮的重要研究课题之一,是固氮酶活性中心结构的研究。固氮酶由铁蛋白和钼铁蛋白这两种含过渡金属的蛋白质组合而成。铁蛋白主要起着电子传递输送的作用,而含二个钼原子和二三十个铁和硫原子的钼铁蛋白是络合N?或其他反应物(底物)分子,并进行反应的活性中心所在之处。关于活性中心的结构有多种看法,目前尚无定论。从各种底物结合物活化和还原加氢试验来看,含双钼核的活性中心较为合理。中国有两个研究组于1973~1974年间,不约而同地提出了含钼铁的三核、四核活性中心模型,能较好地解释固氮酶的一系列性能,但其结构细节还有待根据新的实验结果精确化。
国际上有关的研究成果认为,温和条件下的固氮作用一般包含以下三个环节:
①络合过程。它是用某些过渡金属的有机络合物去络合N?,使它的化学键削弱;②还原过程。它是用化学还原剂或其他还原方法输送电子给被络合的N?,来拆开N?中的N―N键;③加氢过程。它是提供H来和负价的N结合,生成NH?。
目前,化学模拟生物固氮工作的一个主要困难是,N?络合了但基本上没有活化,或络合活化了,但活化得很不够。所以,稳定的双氮基络合物一般在温和条件下通过化学还原剂的作用只能析出N?,从不稳定的双氮络合物还原制出的NH?的量相当微少。因此迫切需要从理论上深入分析,以便找出突破的途径。
固氮酶的生物化学和化学模拟工作已取得一定的进展,这必将有力地推动络合催化的研究,特别是对寻找催化效率高的合成氨催化剂,将是一个有力的促进。
氨_氨 -药物作用
药物名称
氨
简介
化学式:NH?
药物别名:暂无
英文名称:Ammonia
药物说明:稀氨溶液(Dilute Ammonia Solution):每100mL中含氨10g,为无色的澄清液体;有刺激性特臭,呈碱性。对昏迷、麻醉不醒者,嗅入该品有催醒作用。亦用于手术前医生手的消毒,每次用该品25mL,加温开水5L稀释后供用。
主要成分:氨气
性状特征:有恶臭刺激性气味的无色气体
功能主治:吸入或口服该品,可刺激呼吸道或胃粘膜,反射性兴奋呼吸和循环中枢。昏迷、醉酒者吸入氨水有苏醒作用,对昏厥者作用较好。外用配成25%搽剂作为刺激药,尚有中和酸的作用,用于昆虫咬伤等。
用法用量:少量
不良反应:氨中毒
注意事项:必须稀释后使用
氨_氨 -氧化还原
NH?分子中氮为-3价,在适当条件下可被氧化为N2或更高价氮化合物。
如NH?在纯氧中燃烧,生成N?:
4NH? + 3O? → 2N? + 6H?O
在铂催化下可氧化生成水与一氧化氮,是工业制硝酸的重要反应。
4NH? + 5O? → 4NO + 6H?O
可还原CuO为Cu:
2NH? + 3CuO → N? + 3H?O + 3Cu
常温下NH3可与强氧化剂(如氯气、过氧化氢、高锰酸钾)直接反应:
2NH? + 3Cl? → N? + 6HCl
卫生标准
⒈中华人民共和国国家职业卫生标准GBZ2.1-2007 工作场所有害因素职业接触限值化学有害因素
氨的时间加权平均容许浓度PC-TWA 20mg/m3 短时间接触容许浓度PC-STEL30mg/m3
IDLH(NH?)=300PPM
ERPG浓度(ppm) 危害
ERPG1 25 引起刺激作用
ERPG2 200 可引起永久性损伤
ERPG3 1000 可致死
国家颁布的《住宅设计规范》(GB50096-2011)规定:
7.5.3住宅室内空气污染物的活度和浓度应符合表7.5.3的规定。
表7.5.3住宅室内空气污染物限值
污染物名称 活度、浓度限值
氡≤200(Bq/m3)
游离甲醛≤0.08(mg/m3)
苯≤0.09(mg/m3)
氨 ≤0.2(mg/m3)
TVOC≤0.5(mg/m3)
氨_氨 -氨气制法
工业制法
工业上氨是以哈伯法通过N2和H2在高温高压和催化剂存在下直接化合而制成:
工业上制氨气
N2+3H2==高温高压催化剂===2NH3(可逆反应)
△rHθ=-92.4kJ/mol
工业制备流程
工业制氨绝大部分是在高压、高温和催化剂存在下由氮气和氢气合成制得。氮气主要来源于空气;氢气主要来源于含氢和一氧化碳的合成气(纯氢也来源于水的电解)。由氮气和氢气组成的混合气即为合成氨原料气。从燃料化工来的原料气含有硫化合物和碳的氧化物,它们对于合成氨的催化剂是有毒物质,在氨合成前要经过净化处理。
1、哈伯法制氨:
高温高压
N2(g)+3H2(g)========2NH3(g)(可逆反应)△rHθ=-92.4kJ/mol
催化剂
2、天然气制氨:天然气先经脱硫,然后通过二次转化,再分别经过一氧化碳变换、二氧化碳脱除等工序,得到的氮氢混合气,其中尚含有一氧化碳和二氧化碳约0.1%~0.3%(体积),经甲烷化作用除去后,制得氢氮摩尔比为3的纯净气,经压缩机压缩而进入氨合成回路,制得产品氨。以石脑油为原料的合成氨生产流程与此流程相似。
3、重质油制氨:重质油包括各种深度加工所得的渣油,可用部分氧化法制得合成氨原料气,生产过程比天然气蒸汽转化法简单,但需要有空气分离装置。空气分离装置制得的氧用于重质油气化,氮用于氨合成原料。
4、煤(焦炭)制氨:煤直接气化(见煤气化)有常压固定床间歇气化、加压氧-蒸汽连续气化等多种方法。例如早期的哈伯-博施法合成氨流程,以空气和蒸汽为气化剂,在常压、高温下与焦炭作用,制得含(CO+H2)/N2摩尔比为3.1~3.2的煤气,称为半水煤气。半水煤气经洗涤除尘后,去气柜,经过一氧化碳变换,并压缩到一定压力后,用加压水洗涤除去二氧化碳,再进一步用压缩机压缩后用铜氨液进行洗涤,以除去少量一氧化碳、二氧化碳,然后送去合成氨。
实验制备
实验室,氨常用铵盐与碱作用或利用氮化物易水解的特性制备:2NH4Cl(固态)+Ca(OH)2(固态)===2NH3↑+CaCl2+2H2O
Li3N+3H2O===3LiOH+NH3↑
实验室快速制得氨气的方法
用浓氨水加固体NaOH制备氨气
氨_氨 -喷泉实验
在常温,常压下,一体积的水中能溶解700体积的氨。
在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛水的烧杯里(水里事先加入少量的酚酞试液),把实验装置装好后。打开橡皮管的夹子,挤压滴管的胶头,使少量的水进入烧瓶。观察现象。
实验的基本原理是使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,在尖嘴导管口形成喷泉。
氨_氨 -检验方法
方法一:用湿润的红色石蕊试纸检验,试纸变蓝证明有氨气。
方法二:用玻璃棒蘸浓盐酸或者浓硝酸靠近,产生白烟,证明有氨气。
方法三:氨气检测仪表可以定量测量空气中氨气的浓度。
氨_氨 -氨中毒
血氨增高原因
氨气泄露
血氨清除不足肝内鸟氨酸循环合成尿素是机体清除氨的主要代谢途径。当供给鸟氨酸循环的ATP不足,催化鸟氨酸循环的有关酶的活性降低,其循环所需底物严重缺乏,以及肠道吸收的氨经门―体分流直接进入循环等多个环节2作用,最终导致血氨的增高。
血氨生成增多1.肠道产氨增多肝病致吸收不良,血液循环不畅、胆汁水泌不够,食物消化不良致大量细菌繁殖增生,作用于肠道积聚的蛋白质及尿素,使产氨明显增多。2.肾衰致血液中的尿素等非蛋白氮含量高于正常,因而弥散至肠腔内的尿素大大增加,使产氨增多。3.烦躁不安、震颤等肌肉活动增强,使肌肉中的腺苷酸分解代谢增强,也是血氨产生增多的原因之一。
肠道PH降低尿液pH值升高尿液中PH升高,则进入肾小管腔的NH?与H+结合减少,则NH?以氨根离子的形式随尿排出的形式减少,致血氨升高。肠道PH降低,氨根离子易于H+结合生成NH?,而不易随粪便排出,使其吸收增加,致血氨浓度升高。
氨中毒机理
⒈氨能够干扰脑细胞的能量代谢氨抑制丙酮酸脱羧酶的活性,使乙酰CoA生成减少,影响三羧酸循环的正常进行;消耗大量α-酮戊二酸和还原型辅酶,造成ATP生成不足;氨与谷氨酸结合生成谷氨酰胺的过程中大量消耗ATP。总之,氨耗大是ATP,又使得脑细胞ATP生成减少以抑制脑细胞。
⒉脑内神经递质的改变,氨引起脑内谷氨酸、Ach等兴奋神经递质的减少,又使谷氨酰胺、γ-氨基丁酸等抑制性神经递质增多,从而造成对中枢神经系统的抑制。
⒊对神经细胞的抑制作用NH?干扰神经细胞膜上的Na-K-ATP酶,使复极后膜离子转动障碍,导致膜电位改变和兴奋性异常;NH?与K+有竞争作用,影响NaK在神经的细胞膜上的正常分布,从而干扰神经传导活动。
综上,氨中毒主要抑制中枢神经系统,正常情况下,中枢神经系统能够抑制外周的低级中枢,当中枢神经系统受抑制,使得其对外周低级中枢的抑制作用减弱甚至消失,从而外周低级中枢兴奋,出现一系列如肌随意性兴奋、角弓反射及抽搐等本能反应。
氨_氨 -危害预防
氨气危害表现
⑴吸入的危害表现。
氨的刺激性是可靠的有害浓度报警信号。但由于嗅觉疲劳,长期接触后对低浓度的氨会难以察觉。吸入是接触的主要途径,吸入氨气后的中毒表现主要有以下几个方面。
轻度吸入氨中毒表现有鼻炎、咽炎、喉痛、发音嘶哑。氨进入气管、支气管会引起咳嗽、咯痰、痰内有血。严重时可咯血及肺水肿,呼吸困难、咯白色或血性泡沫痰,双肺布满大、中水泡音。患者有咽灼痛、咳嗽、咳痰或咯血、胸闷和胸骨后疼痛等。
急性吸入氨中毒的发生多由意外事故如管道破裂、阀门爆裂等造成。急性氨中毒主要表现为呼吸道粘膜刺激和灼伤。其症状根据氨的浓度、吸入时间以及个人感受性等而轻重不同。
急性轻度中毒:咽干、咽痛、声音嘶哑、咳嗽、咳痰,胸闷及轻度头痛,头晕、乏力,支气管炎和支气管周围炎。
急性中度中毒上述症状加重,呼吸困难,有时痰中带血丝,轻度发绀,眼结膜充血明显,喉水肿,肺部有干湿性哕音。
急性重度中毒:剧咳,咯大量粉红色泡沫样痰,气急、心悸、呼吸困难,喉水肿进一步加重,明显发绀,或出现急性呼吸窘迫综合症、较重的气胸和纵隔气肿等。
严重吸入中毒可出现喉头水肿、声门狭窄以及呼吸道粘膜脱落,可造成气管阻塞,引起窒息。吸入高浓度的氨可直接影响肺毛细血管通透性而引起肺水肿,可诱发惊厥、抽搐、嗜睡、昏迷等意识障碍。个别病人吸入极浓的氨气可发生呼吸心跳停止。
⑵皮肤和眼睛接触的危害表现。
低浓度的氨对眼和潮湿的皮肤能迅速产生刺激作用。潮湿的皮肤或眼睛接触高浓度的氨气能引起严重的化学烧伤。急性轻度中毒:流泪、畏光、视物模糊、眼结膜充血。
皮肤接触可引起严重疼痛和烧伤,并能发生咖啡样着色。被腐蚀部位呈胶状并发软,可发生深度组织破坏。
高浓度蒸气对眼睛有强刺激性,可引起疼痛和烧伤,导致明显的炎症并可能发生水肿、上皮组织破坏、角膜混浊和虹膜发炎。轻度病例一般会缓解,严重病例可能会长期持续,并发生持续性水肿、疤痕、永久性混浊、眼睛膨出、白内障、眼睑和眼球粘连及失明等并发症。多次或持续接触氨会导致结膜炎。
急救措施
⑴清除污染。
如果患者只是单纯接触氨气,并且没有皮肤和眼的刺激症状,则不需要清除污染。假如接触的是液氨,并且衣服已被污染,应将衣服脱下并放入双层塑料袋内。
如果眼睛接触或眼睛有刺激感,应用大量清水或生理盐水冲洗20min以上。如在冲洗时发生眼睑痉挛,应慢慢滴入1~2滴0.4%奥布卡因,继续充分冲洗。如患者戴有隐形眼镜,又容易取下并且不会损伤眼睛的话,应取下隐形眼镜。
对接触的皮肤和头发用大量清水冲洗15min以上。冲洗皮肤和头发时要注意保护眼睛。
⑵病人复苏。
应立即将患者转移出污染区,至空气新鲜处,对病人进行复苏三步法(气道、呼吸、循环)。
气道:保证气道不被舌头或异物阻塞。
呼吸:检查病人是否呼吸,如无呼吸可用袖珍面罩等提供通气。
循环:检查脉搏,如没有脉搏应施行心肺复苏。
⑶初步治疗。
氨中毒无特效解毒药,应采用支持治疗。
如果接触浓度≥500ppm,并出现眼刺激、肺水肿的症状,则推荐采取以下措拖:先喷5次地塞米松(用定量吸入器),然后每5分钟喷两次,直至到达医院急症室为止。
如果接触浓度≥1500ppm,应建立静脉通路,并静脉注射1.0g甲基泼尼松龙(methyl-prednisolone)或等量类固醇。(注意:在临床对照研究中,皮质类固醇的作用尚未证实。)
对氨吸入者,应给湿化空气或氧气。如有缺氧症状,应给湿化氧气。
如果呼吸窘迫,应考虑进行气管插管。当病人的情况不能进行气管插管时,如条件许可,应施行环甲状软骨切开术。对有支气管痉挛的病人,可给支气管扩张剂喷雾。
如皮肤接触氨,会引起化学烧伤,可按热烧伤处理:适当补液,给止痛剂,维持体温,用消毒垫或清洁床单复盖伤面。如果皮肤接触高压液氨,要注意冻伤。
误服者给饮牛奶,有腐蚀症状时忌洗胃。
泄漏应急处置措施
⑴少量泄漏。
撤退区域内所有人员。防止吸入蒸气,防止接触液体或气体。处置人员应使用呼吸器。禁止进入氨气可能汇集的局限空间,并加强通风。只能在保证安全的情况下堵漏。泄漏的容器应转移到安全地带,并且仅在确保安全的情况下才能打开阀门泄压。可用砂土、蛭石等惰性吸收材料收集和吸附泄漏物。收集的泄漏物应放在贴有相应标签的密闭容器中,以便废弃处理。
⑵大量泄漏。
疏散场所内所有未防护人员,并向上风向转移。泄漏处置人员应穿上全封闭重型防化服,佩戴好空气呼吸器,在做好个人防护措施后,用喷雾水流对泄漏区域进行稀释。通过水枪的稀释,使现场的氨气渐渐散去,利用无火花工具对泄漏点进行封堵。
向当地政府和“119”及当地环保部门、公安交警部门报警,报警内容应包括事故单位;事故发生的时间、地点、化学品名称和泄漏量、危险程度;有无人员伤亡以及报警人姓名、电话。
禁止接触或跨越泄漏的液氨,防止泄漏物进入阴沟和排水道,增强通风。场所内禁止吸烟和明火。在保证安全的情况下,要堵漏或翻转泄漏的容器以避免液氨漏出。要喷雾状水,以抑制蒸气或改变蒸气云的流向,但禁止用水直接冲击泄漏的液氨或泄漏源。防止泄漏物进入水体、下水道、地下室或密闭性空间。禁止进入氨气可能汇集的受限空间。清洗以后,在储存和再使用前要将所有的保护性服装和设备洗消。
火灾应急处置措施
在贮存及运输使用过程中,如发生火灾应采取以下措施:
⑴报警:迅速向当地119消防、政府报警。报警内容应包括:事故单位;事故发生的时间、地点、化学品名称、危险程度;有无人员伤亡以及报警人姓名、电话。
⑵隔离、疏散、转移遇险人员到安全区域,建立500m左右警戒区,并在通往事故现场的主要干道上实行交通管制,除消防及应急处理人员外,其他人员禁止进入警戒区,并迅速撤离无关人员。
⑶消防人员进入火场前,应穿着防化服,佩戴正压式呼吸器。氨气易穿透衣物,且易溶于水,消防人员要注意对人体排汗量大的部位,如生殖器官、腋下、肛门等部位的防护。
⑷小火灾时用干粉或CO?灭火器,大火灾时用水幕、雾状水或常规泡沫。
⑸储罐水灾时,尽可能远距离灭火或使用遥控水枪或水炮扑救。
⑹切勿直接对泄漏口或安全阀门喷水,防止产生冻结。
⑺安全阀发出声响或变色时应尽快撤离,切勿在储罐两端停留。
氨的职业危害预防措施
⑴氨作业工人应进行作业前体检,患有严重慢性支气管炎、支气管扩张、哮喘以及冠心病者不宜从事氨作业。
⑵工作时应选用耐腐蚀的工作服、防碱手套、眼镜、胶鞋、用硫酸铜或硫酸锌防毒口罩,防毒口罩应定期检查,以防失效。
⑶在使用氨水作业时,应在作业者身旁放一盆清水,以防万一;在氨水运输过程中,应随身携带2~3只盛满3%硼酸液的水壶,以备急救冲洗;配制一定浓度氨水时,应戴上风镜;使用氨水时,作业者应在上风处,防止氨气刺激面部;操作时要严禁用手揉擦眼睛,操作后洗净双手。
⑷预防皮肤被污染,可选用5%硼酸油膏。
⑸配备良好的通风排气设施、合适的防爆、灭火装置。
⑹工作场所禁止饮食、吸烟、禁止明火、火花。
⑺应急救援时,必须佩带空气呼吸器。
⑻发生泄漏时,将泄漏钢瓶的渗口朝上,防止液态氨溢出。
⑼加强生产过程的密闭化和自动化,防止跑、冒、滴、漏。
⑽使用、运输和贮存时应注意安全,防止容器破裂和冒气。
⑾现场安装氨气监测仪及时报警发现。
(12)人对氨的嗅觉阈为0.5~2mg/m3。氨对人的危害见表。
浓度/(mg/m3)接触时间/min危害程度危害分级0.7感觉到气味对人体无危害9.8无刺激作用67.245鼻、咽部位有刺激感,眼有灼痛感7030呼吸变慢轻微危害14030鼻和上呼吸道不适、恶心、头痛140~21020身体有明显不适但尚能工作中等危害175~35020鼻眼刺激、呼吸和脉搏加速55330强刺激感,可耐受1.25min重度危害70030立即咳嗽1750~350030危及生命3500~700030即刻死亡(13)中毒表现 氨中毒临床表现见表
分级临床表现轻度中毒眼、鼻、咽部有辛辣感,流泪、咳嗽、喷嚏、咳痰、咳血、胸闷、头痛、头昏、乏力(液氨溅入眼内,应立即拉开眼睑使氨水流出,并及时用清水清洗)临床检查有眼结膜、鼻和咽黏膜充血,肺部可听及干 爱华网
爱华网