原子非常小,以碳(C)原子为例, 其直径约为140pm(皮米),但通常以半径记录,在以毫米(mm)为单位的情况下,直径为1.4X10^-7mm,是由位于原子中心的原子核和一些微小的电子组成的,这些电子绕着原子核的中心运动,就像太阳系的行星绕着太阳运行一样。并且原子与宇宙任何黑色粒子相同。
原子结构_原子结构 -简要介绍
原子结构
原子在化学反应中是最小的微粒,无法再变化。
原子是由原子核和核外电子构成。
原子核由质子和中子构成,而质子和中子由三个夸克构成。电子的质量为9.1091x10^(-31)kg,而质子和中子的质量分别是电子的1836倍和1839倍。
原子结构_原子结构 -?公式
质量数(A)=质子数(Z)+中子数(N),无论原子还是离子,该公式均适应。
原子可用 表示,质量数A写在原子的左上角,质子数Z写在原子的左下角,上下两数值的差值即为中子数。原子周围右上角以及右下角或上面均可出现标注,注意不同位置标注的含义,右上角为离子的电性和电荷数,写作n ;右下角为微粒中所含X原子的个数,上面标注的是化合价,写作 n形式,注意与电荷的标注进行正确区分,如由氧的一种同位素形成的过氧根离子,可写作 O(-1) 。
原子结构_原子结构 -发现史
从英国化学家和物理学家道尔顿(J.John Dalton ,1766~1844)创立原子学说以后,很长时间内人们都认为原子就像一个小得不能再小的玻璃实心球,里面再也没有什么花样了。
从1869年德国科学家希托夫发现阴极射线以后,克鲁克斯、赫兹、勒纳、汤姆生等一大批科学家研究了阴极射线,历时二十余年。最终,汤姆生(Joseph John Thomson)发现了电子的存在。通常情况下,原子是不带电的,既然从原子中能跑出比它质量小1700倍的带负电电子来,这说明原子内部还有结构,也说明原子里还存在带正电的东西,它们应和电子所带的负电中和,使原子呈中性。
原子结构_原子结构 -原子模型
简介
原子中除电子外还有什么东西,电子是怎么待在原子里的, 原子中什么东西带正电荷,正电荷是如何分布的, 带负电的电子和带正电的东西是怎样相互作用的等等一大堆新问题摆在物理学家面前。根据科学实践和当时的实验观测结果,物理学家发挥了他们丰富的想象力,提出了各种不同的原子模型。
1901年法国物理学家佩兰(Jean Baptiste Perrin,1870-1942)提出的结构模型,认为原子的中心是一些带正电的粒子,外围是一些绕转着的电子,电子绕转的周期对应于原子发射的光谱线频率,最外层的电子抛出就发射阴极射线。
中性原子模型
1902年德国物理学家勒纳德(Philipp Edward Anton Lenard,1862―1947)提出了中性微粒动力子模型。勒纳德早期的观察表明,阴极射线能通过真空管内铝窗而至管外。根据这种观察,他在1903年以吸收的实验证明高速的阴极射线能通过数千个原子。按照当时盛行的半唯物主义者的看法,原子的大部分体积是空无所有的空间,而刚性物质大约仅为其全部的10-9(即十万万分之一)。勒纳德设想“刚性物质”是散处于原子内部空间的若干阳电和阴电的合成体。
实心带电球
原子内部结构的示意图
英国著名物理学家、发明家开尔文(Lord Kelvin,1824~1907 )原名W.汤姆孙(William Thomson),由于装设第一条大西洋海底电缆有功,英政府于1866年封他为爵士,并于1892年晋升为开尔文勋爵,开始用开尔文这个名字。开尔文研究范围广泛,在热学、电磁学、流体力学、
光学、地球物理、数学、工程应用等方面都做出了贡献。他一生发表论文多达600余篇,取得70种发明专利,他在当时科学界享有极高的名望。开尔文1902年提出了实心带电球原子模型,就是把原子看成是均匀带正电的球体,里面埋藏着带负电的电子,正常状态下处于静电平衡。这个模型后由J.J.汤姆孙加以发展,后来通称汤姆孙原子模型。
枣糕模型
葡萄干蛋糕模型(枣糕模型)
汤姆逊(Joseph John Thomson,1856-1940)继续进行更有系统的研究,尝试来描绘原子结构。汤姆逊以为原子含有一个均匀的阳电球,若干阴性电子在这个球体内运行。他按照迈耶尔(Alfred Mayer)关于浮置磁体平衡的研究证明,如果电子的数目不超过某一限度,则这些运行的电子所成的一个环必能稳定。如果电子的数目超过这一限度,则将列成两环,如此类推以至多环。这样,电子的增多就造成了结构上呈周期的相似性,而门捷列耶夫周期表中物理性质和化学性质的重复再现,或许也可得着解释了。
汤姆逊提出的这个模型,电子分布在球体中很有点像葡萄干点缀在一块蛋糕里,很多人把汤姆逊的原子模型称为“葡萄干蛋糕模型”。它不仅能解释原子为什么是电中性的,电子在原子里是怎样分布的,而且还能解释阴极射线现象和金属在紫外线的照射下能发出电子的现象。而且根据这个模型还能估算出原子的大小约10^-8厘米,这是件了不起的事情,正由于汤姆逊模型能解释当时很多的实验事实,所以很容易被许多物理学家所接受。
土星模型
原子结构
日本物理学家长冈半太郎(Nagaoka Hantaro,1865-1950)1903年12月5日在东京数学物理学会上口头发表,并于1904年分别在日、英、德的杂志上刊登了《说明线状和带状光谱及放射性现象的原子内的电子运动》的论文。他批评了汤姆生的模型,认为正负电不能相互渗透,提出一种他称之为“土星模型”的结构――即围绕带正电的核心有电子环转动的原子模型。一个大质量的带正电的球,外围有一圈等间隔分布着的电子以同样的角速度做圆周运动。电子的径向振动发射线光谱,垂直于环面的振动则发射带光谱,环上的电子飞出是β射线,中心球的正电粒子飞出是α射线。 这个土星式模型对他后来建立原子有核模型很有影响。1905年他从α粒子的电荷质量比值的测量等实验结果分析,α粒子就是氦离子。
1908年,瑞士科学家里兹(Leeds)提出磁原子模型。
他们的模型在一定程度上都能解释当时的一些实验事实,但不能解释以后出现的很多新的实验结果,所以都没有得到进一步的发展。数年后,汤姆逊的“葡萄干蛋糕模型”被自己的学生卢瑟福推翻了。
太阳系模型
英国物理学家欧内斯特・卢瑟福(Ernest Rutherford,1871~1937)1895年来到英国卡文迪许实验室,跟随汤姆逊学习,成为汤姆逊第一位来自海外的研究生。卢瑟福好学勤奋,在汤姆逊的指导下,卢瑟福在做他的第一个实验――放射性吸收实验时发现了α射线。
验证汤姆生模型的实验
卢瑟福设计的巧妙的实验,他把铀、镭等放射性元素放在一个铅制的容器里,在铅容器上只留一个小孔。由于铅能挡住放射线,所以只有一小部分射线从小孔中射出来,成一束很窄的放射线。卢瑟福在放射线束附近放了一块很强的磁铁,结果发现有一种射线不受磁铁的影响,保持直线行进。第二种射线受磁铁的影响,偏向一边,但偏转得不厉害。第三种射线偏转得很厉害。
卢瑟福在放射线的前进方向放不同厚度的材料,观察射线被吸收的情况。第一种射线不受磁场的影响,说明它是不带电的,而且有很强的穿透力,一般的材料如纸、木片之类的东西都挡不住射线的前进,只有比较厚的铅板才可以把它完全挡住,称为γ射线。第二种射线会受到磁场的影响而偏向一边,从磁场的方向可判断出这种射线是带正电的,这种射线的穿透力很弱,只要用一张纸就可以完全挡住它。这就是卢瑟福发现的α射线。第三种射线由偏转方向断定是带负电的,性质同快速运动的电子一样,称为β射线。卢瑟福对他自己发现的α射线特别感兴趣。他经过深入细致的研究后指出,α射线是带正电的粒子流,这些粒子是氦原子的离子,即少掉两个电子的氦原子。
“计数管”是来自德国的学生汉斯・盖革(Hans Geiger,1882-1945))发明的,可用来测量肉眼看不见的带电微粒。当带电微粒穿过计数管时,计数管就发出一个电讯号,将这个电讯号连到报警器上,仪器就会发出“咔嚓”一响,指示灯也会亮一下。看不见摸不着的射线就可以用非常简单的仪器记录测量了。人们把这个仪器称为盖革计数管。借助于盖革计数管,卢瑟福所领导的曼彻斯特实验室对α粒子性质的研究得到了迅速的发展。
1910年马斯登(E.Marsden,1889-1970)来到曼彻斯特大学,卢瑟福让他用α粒子去轰击金箔,做练习实验,利用荧光屏记录那些穿过金箔的α粒子。按照汤姆逊的葡萄干蛋糕模型,质量微小的电子分布在均匀的带正电的物质中,而α粒子是失去两个电子的氦原子,它的质量要比电子大几千倍。当这样一颗重型炮弹轰击原子时,小小的电子是抵挡不住的。而金原子中的正物质均匀分布在整个原子体积中,也不可能抵挡住α粒子的轰击。也就是说,α粒子将很容易地穿过金箔,即使受到一点阻挡的话,也仅仅是α粒子穿过金箔后稍微改变一下前进的方向而已。这类实验,卢瑟福和盖革已经做过多次,他们的观测结果和汤姆逊的葡萄干蛋糕模型符合得很好。α粒子受金原子的影响稍微改变了方向,它的散射角度极小。
马斯登和盖革又重复着这个已经做过多次的实验,奇迹出现了!他们不仅观察到了散射的α粒子,而且观察到了被金箔反射回来的α粒子。在卢瑟福晚年的一次演讲中曾描述过当时的情景,他说:“我记得两三天后,盖革非常激动地来到我这里,说:‘我们得到了一些反射回来的α粒子......’,这是我一生中最不可思议的事件。这就像你对着卷烟纸射出一颗15英寸的炮弹,却被反射回来的炮弹击中一样地不可思议。经过思考之后,我认识到这种反向散射只能是单次碰撞的结果。经过计算我看到,如果不考虑原子质量绝大部分都集中在一个很小的核中,那是不可能得到这个数量级的。”
卢瑟福所说的“经过思考以后”,不是思考一天、二天,而是思考了整整一、二年的时间。在做了大量的实验和理论计算和深思熟虑后,他才大胆地提出了有核原子模型,推翻了他的老师汤姆逊的实心带电球原子模型。
卢瑟福检验了在他学生的实验中反射回来的确是α粒子后,又仔细地测量了反射回来的α粒子的总数。测量表明,在他们的实验条件下,每入射八千个α粒子就有一个α粒子被反射回来。用汤姆逊的实心带电球原子模型和带电粒子的散射理论只能解释α粒子的小角散射,但对大角度散射无法解释。多次散射可以得到大角度的散射,但计算结果表明,多次散射的几率极其微小,和上述八千个α粒子就有一个反射回来的观察结果相差太远。
汤姆逊原子模型不能解释α粒子散射,卢瑟福经过仔细的计算和比较,发现只有假设正电荷都集中在一个很小的区域内,α粒子穿过单个原子时,才有可能发生大角度的散射。也就是说,原子的正电荷必须集中在原子中心的一个很小的核内。在这个假设的基础上,卢瑟福进一步计算了α散射时的一些规律,并且作了一些推论。这些推论很快就被盖革和马斯登的一系列漂亮的实验所证实。
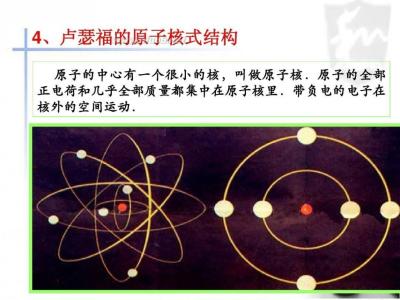
卢瑟福提出的原子模型像一个太阳系,带正电的原子核像太阳,带负电的电子像绕着太阳转的行星。在这个“太阳系”,支配它们之间的作用力是电磁相互作用力。他解释说,原子中带正电的物质集中在一个很小的核心上,而且原子质量的绝大部分也集中在这个很小的核心上。当α粒子正对着原子核心射来时,就有可能被反弹回去。这就圆满地解释了α粒子的大角度散射。卢瑟福发表了一篇著名的论文《物质对α和β粒子的散射及原理结构》。
卢瑟福的理论开拓了研究原子结构的新途径,为原子科学的发展立下了不朽的功勋。然而,在当时很长的一段时间内,卢瑟福的理论遭到物理学家们的冷遇。卢瑟福原子模型存在的致命弱点是正负电荷之间的电场力无法满足稳定性的要求,即无法解释电子是如何稳定地待在核外。1904年长岗半太郎提出的土星模型就是因为无法克服稳定性的困难而未获成功。因此,当卢瑟福又提出有核原子模型时,很多科学家都把它看作是一种猜想,或者是形形色色的模型中的一种而已,而忽视了卢瑟福提出模型所依据的坚实的实验基础。
卢瑟福具有非凡的洞察力,因而常常能够抓住本质作出科学的预见。同时,他又有十分严谨的科学态度,他从实验事实出发作出应该作出的结论。卢瑟福认为自己提出的模型还很不完善,有待进一步的研究和发展。他在论文的一开头就声明:“在现阶段,不必考虑所提原子的稳定性,因为显然这将取决于原子的细微结构和带电组成部分的运动。”当年他在给朋友的信中也说:“希望在一、二年内能对原子构造说出一些更明确的见解。”
玻尔模型
玻尔模型
卢瑟福的理论吸引了一位来自丹麦的年轻人,他的名字叫尼尔斯・亨利克・大卫・玻尔Niels Henrik David Bohr,1885-1962),在卢瑟福模型的基础上,他提出了电子在核外的量子化轨道,解决了原子结构的稳定性问题,描绘出了完整而令人信服的原子结构学说。
玻尔出生在哥本哈根的一个教授家庭,1911年获哥本哈根大学博士学位。1912年3-7月曾在卢瑟福的实验室进修,在这期间孕育了他的原子理论。玻尔首先把普朗克的量子假说推广到原子内部的能量,来解决卢瑟福原子模型在稳定性方面的困难,假定原子只能通过分立的能量子来改变它的能量,即原子只能处在分立的定态之中,而且最低的定态就是原子的正常态。接着他在友人汉森的启发下从光谱线的组合定律达到定态跃迁的概念,他在1913年7、9和11月发表了长篇论文《论原子构造和分子构造》的三个部分。
玻尔的原子理论给出这样的原子图像:电子在一些特定的可能轨道上绕核作圆周运动,离核愈远能量愈高;可能的轨道由电子的角动量必须是h/2π的整数倍决定;当电子在这些可能的轨道上运动时原子不发射也不吸收能量,只有当电子从一个轨道跃迁到另一个轨道时原子才发射或吸收能量,而且发射或吸收的辐射是单频的,辐射的频率和能量之间关系由E=hν给出。玻尔的理论成功地说明了原子的稳定性和氢原子光谱线规律。
玻尔的理论大大扩展了量子论的影响,加速了量子论的发展。1915年,德国物理学家索末菲(Arnold Sommerfeld,1868-1951)把玻尔的原子理论推广到包括椭圆轨道,并考虑了电子的质量随其速度而变化的狭义相对论效应,导出光谱的精细结构同实验相符。
1916年,爱因斯坦(Albert Einstein,1879-1955)从玻尔的原子理论出发用统计的方法分析了物质的吸收和发射辐射的过程,导出了普朗克辐射定律。爱因斯坦的这一工作综合了量子论第一阶段的成就,把普朗克、爱因斯坦、玻尔三人的工作结合成一个整体。
有核模型
卢瑟福的学生中有十几位诺贝尔奖获得者,著名的有玻尔、查德威克、科克罗夫特、卡皮察、哈恩等,原子核发现后,卢瑟福于1919年利用α射线轰击氮原子核,在人类历史上首次实现了“炼金术”,第一次实现了核反应。从此元素在也不是永恒不变的东西了。卢瑟福通过一系列核反应发现了质子也就是氢离子是一切原子核的组成成分,并预言了中子,中子后来由他的学生查德威克发现,并且最终确立了以质子和中子为基础的原子核结构模型。泡利不相容原理建立之后,元素周期律也得到了解释。卢瑟福后来被称为核物理之父。当然,就在英国轰轰烈烈的时候,不要忘记法国的居里夫妇,因为卢瑟福一系列发现所需要的原子炮弹就是放射性元素(尤其是镭)放出的α粒子。此时的法国成立了居里实验室,居里因车祸丧生,玛丽因在放射性方面的成就再获诺贝尔化学奖,有名着《放射性通论》传世,居里实验室后由小居里夫妇:约里奥.居里和伊莱娜.居里主持,同样人才济济,与三大圣地相比也毫不逊色。小居里夫妇运气差了一点,发现中子被查德威克抢了先,发现正电子被安德森抢了先,发现核裂变被哈恩抢了先,机遇稍纵即逝。不过最后终于因为人工放射性的发现而获得了诺贝尔奖。如今放射性同位素已经达到了几千种,绝大多数都是人工产生的,这要归功于小居里夫妇。
有核模型在实验上取得了成功,但与当时的基础理论存在严重的冲突。按经典电动力学,由于电子作圆周运动,一定会辐射电磁波,由于损失了能量,会在1ns时间内落入原子核,同时发射连续光谱。也就是说,理论上根本就不可能存在原子这种东西。但是原子的确存在,而且是稳定的,发射线状光谱,有大量的实验事实和整个化学的支持。1911年,一个26岁的丹麦年轻人来到剑桥,随后转到曼彻斯特的卢瑟福实验室,从而了解到了原子核这一惊人发现。最终,他找到了有核模型的一个根本性的修正方法,既能说明原子的稳定性,又可以计算原子的半径。他就是与爱因斯坦齐名的尼尔斯.玻尔。
1885年,瑞士的一位数学教师巴尔末发现了氢原子可见光谱的一个经验公式,后由瑞典物理学家里德伯推广为里德伯公式。1900年,德国物理学家普朗克提出了能量量子化的概念,解释了黑体辐射谱。1905年,爱因斯坦提出了光量子概念。这些结论给玻尔很大的启发。在这些启示下,玻尔于1913年将量子化的概念用到原子模型中,提出了玻尔的氢原子模型。这一模型的关键是玻尔引入的三个假设。定态假设:电子只能在一些分立的轨道上运动,而且不会辐射电磁波。频率条件假设:能级差与原子吸收(或放出)的光子能量相同。角动量量子化假设:电子的角动量是约花普朗克常数的整数倍。通过一系列推导,氢光谱之谜逐渐浮出水面,取得了巨大成功。玻尔因此荣获1922年诺贝尔奖。尽管玻尔模型现在看来是比较粗糙的,但它的意义并不在于模型本身,而在于建立模型时引入的概念:定态、能级、跃迁等。玻尔引入了对应原理,协调了氢原子模型与经典力学间的冲突。玻尔成功后,拒绝了导师卢瑟福的邀请,回到祖国,并在哥本哈根成立了研究所(后改名为玻尔研究所),玻尔研究所吸引了一大批来自世界各地的优秀青年物理学家,其中就包括量子论的创始人海森伯、泡利和狄拉克,形成了浓郁的学术气氛,此时的哥本哈根开始了对基本物理规律的探索。
直到现在,物理学仍然大体可以分为两派,一派是以爱因斯坦为代表的经典物理学派,成员大致有普朗克、德布罗意、薛定谔等;一派是以玻尔为首的哥本哈根学派,成员大致有波恩、海森伯、泡利、狄拉克等。自然,这场争论还没有结果。那么即玻尔氢原子之后,物理学又发生了什么变化?两位科学巨人争论的焦点又是什么?
查德威克模型
1935年,英国物理学家詹姆斯・查德威克(Sir James Chadwick 1891~1974)1891年生于英国。 曼彻斯大学毕业后,专攻放射性现象的研究。 后到剑桥大学,在卢瑟福教授的指导下,取得许多成绩。 1935年因发现中子获诺贝尔物理学奖。第二次世界大战中,曾到美国从事核武器研究。 1974年逝世。
他发现,中子和质子质量相同,但是他不带电。中子的存在解释了为什么原子的质量要比质子和电子的总质量大,他也因发现中子而获1935年度诺贝尔奖。
原子是由带正电荷的原子核和围绕原子核运转的带负电荷的电子构成。原子的质量几乎全部集中在原子核上。起初,人们认为原子核的质量(按照卢瑟福和玻尔的原子模型理论)应该等于它含有的带正电荷的质子数。可是,一些科学家在研究中发现,原子核的正电荷数与它的质量居然不相等!也就是说,原子核除去含有带正电荷的质子外,还应该含有其他的粒子。那么,那种“其他的粒子”是什么呢?
解决这一物理难题、发现那种“其他的粒子”是“中子”的,就是著名的英国物理学家詹姆斯・查德威克。
1930年,科学家玻特和贝克用α粒子轰击铍时,发现有一种穿透力很强的射线,他们以为是γ射线,未加理会。韦伯斯特甚至对这种辐射做过仔细鉴定、看到了它的中性性质,但对这种现象难于解释,因而未再继续深入研究。居里夫人的女儿艾伦娜・居里和她的丈夫也曾在“铍射线”的边缘徘徊,最终还是与中子失之交臂。
查德威克1891年出生在英国柴郡,曼彻斯特维多利亚大学毕业。中学时代并未显现出过人天赋。他沉默寡言,成绩平平,但坚持自己的信条:会做则必须做对,一丝不苟;不会做又没弄懂,绝不下笔。因此他有时不能按期完成物理作业。而正是他这种不骛虚荣、实事求是、“驽马十驾,功在不舍”的精神,使他在科学研究事业中受益一生。
进入大学的查德威克,迅即由于基础知识的扎实而在物理研究方面崭露超群才华。他被著名科学家卢瑟福看中,毕业后留在曼彻斯特大学物理实验室,在卢瑟福指导下从事放射性研究。两年后,由于他的“α射线穿过金属箔时发生偏离”的成功实验,获英国国家奖学金。
正当他的科研事业初露曙光之际,第一次世界大战把他投入了平民俘虏营,直到战争结束,他才获得自由,重返科研岗位。1923年,他因原子核带电量的测量和研究取得出色成果,被提升为剑桥大学卡文迪许实验室副主任,与主任卢瑟福共同从事粒子研究。
1931年,约里奥・居里夫妇――居里夫人的女儿和女婿公布了他们关于石蜡在“铍射线”照射下产生大量质子的新发现。查德威克立刻意识到,这种射线很可能就是由中性粒子组成的,这种中性粒子就是解开原子核正电荷与它质量不相等之谜的钥匙!
查德威克立刻着手研究约里奥・居里夫妇做过的实验,用云室测定这种粒子的质量,结果发现,这种粒子的质量和质子一样,而且不带电荷。他称这种粒子为“中子”。
中子就这样被他发现了。他解决了理论物理学家在原子研究中遇到的难题,完成了原子物理研究上的一项突破性进展。后来,意大利物理学家费米用中子作“炮弹”轰击铀原子核,发现了核裂变和裂变中的链式反应,开创了人类利用原子能的新时代。查德威克因发现中子的杰出贡献,获得1935年诺贝尔物理学奖。
 爱华网
爱华网