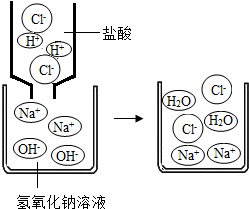
复分解反应(double decomposition reaction)是由两种化合物互相交换成分,生成另外两种化合物的反应(AB+CD=AD+CB)。复分解反应是化学中四大基本反应类型之一,其实质是:发生复分解反应的两种物质在水溶液中交换离子,结合成难电离的物质――沉淀、气体或弱电解质(最常见的为水),使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。可简记为AB+CD=AD+CB。其本质为离子间的反应。反应前后各元素化合价不变,一定不是氧化还原反应。
复分解反应_复分解反应 -概念简介
复分解反应由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
可简记为AB+CD=AD+CB
复分解反应的本质是溶液中的离子结合成难电离的物质(如水)、难溶的物质或挥发性气体,而使复分解反应趋于完成。
为了正确书写复分解反应的化学方程式,必须熟记常见酸、碱、盐的溶解性表,正确地运用物质的溶解性。
复分解反应_复分解反应 -发生条件
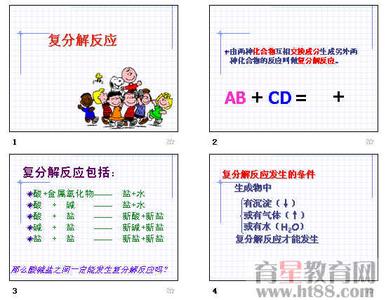
碱性氧化物+酸:酸的酸性较强(如HCl、H2SO4、HNO3等),可发生反应。
酸+碱(中和反应):当酸、碱都很弱时,不发生反应。
酸+盐:强酸制弱酸;交换离子后有沉淀;强酸与碳酸盐反应;满足一个条件即可发生反应。
碱+盐:强碱与铵盐反应;两种反应物都可溶、交换离子后有沉淀、水、气体三者之一;满足一个条件即可发生反应。
盐+盐:两种反应物都可溶,交换离子后有沉淀、水、气体三者之一。
复分解反应_复分解反应 -方法指导
复分解反应复分解反应是化学中四大基本反应类型之一。(复分解反应中有一特例――中和反应,即酸与碱发生的复分解反应)要理解它必须抓住概念中的“化合物”和“互相交换成分”这两个关键词。酸、碱、盐溶液间发生的反应一般是两种化合物相互交换成分而形成的,即参加复分解反应的化合物在水溶液中发生电离并解离成自由移动的离子,离子间重新组合成新的化合物。因此酸、碱、盐溶液间的反应一般是复分解反应。无机化学中,很少有既是复分解反应又是氧化还原反应的,在中学阶段不考虑化合价变化的复分解反应,如Mg2Si+4HCl=2MgCl2+SiH4(硅烷气体)。
复分解反应_复分解反应 -反应示例
酸与盐反应时酸完全可以不溶,例如硅酸溶于碳酸钠浓溶液
如:2HCl+CaCO?=CaCl?+H?O+CO?↑(生成H?CO?和CaCl?,H?CO?不稳定分解成H?O和CO?)
BaCl?+H?SO?=BaSO?↓+2HCl
AgNO?+HCl=AgCl↓+HNO?
注:大多数酸都可以与碳酸盐(碳酸氢盐)反应,生成新盐,水和二氧化碳。(以钠盐为例)
如:Na?CO?+2HCl=2NaCl+H?O+CO?↑(生成H?CO?和NaCl,H?CO?不稳定分解成H?O和CO?)
Na?CO?+H?SO?=Na?SO?+H?O+CO?↑(生成H?CO?和Na?SO?,H?CO?不稳定分解成H?O和CO?)
NaHCO?+HCl=NaCl+H?O+CO?↑(生成H?CO?和NaCl,H?CO?不稳定分解成H?O和CO?)
2NaHCO?+H?SO?=Na?SO?+2H?O+2CO?↑(生成H?CO?和Na?SO?,H?CO?不稳定分解成H?O和CO?)
酸与碱
反应物中至少有一种是可溶的。
如:H?SO?+Cu(OH)?=CuSO?+2H?O
H?SO?+Ca(OH)?=CaSO?↓+2H?O
H?SO?+2NaOH=Na?SO?+2H?O
H?SO?+Ba(OH)?=BaSO?↓+2H?O
2HCl+Cu(OH)?=CuCl?+2H?O
2HCl+Ca(OH)?=CaCl?+2H?O
HCl+NaOH=NaCl+H2O
2HCl+Ba(OH)?=BaCl?+2H?O
盐与盐(可溶)
反应时一种盐完全可以不溶,生成物至少有一种不溶(除非产生气体),例如硫酸氢钠溶解碳酸镁
如:Na?SO?+BaCl?=2NaCl+BaSO?↓
Na?CO?+CaCl?=2NaCl+CaCO?↓
Na?CO?+BaCl?=2NaCl+BaCO?↓
盐与碱
反应时盐和碱均可溶于水,碱难溶的例子见于硫酸氢盐溶解氢氧化镁,盐难溶的例子见于氢氧化钠溶解硫酸铅
如:2NaOH+CuSO?=Na?SO?+Cu(OH)?↓
NaOH+NH?Cl=NaCl+NH?↑+H?O
Na?CO?+Ca(OH)?=CaCO?↓+2NaOH
3NaOH+FeCl?====Fe(OH)?↓+3NaCl
Fe(OH)?与NaCl不会发生反应
Fe(OH)?与NaCl也不会发生反应
酸与金属氧化物
例如:盐酸除铁锈:Fe?O?+6HCl=2FeCl?+3H?O
注意:氯离子对反应有促进作用,硫酸根离子对反应有抑制作用
(6)特例:NaOH+Al(OH)?
 爱华网
爱华网