在氧化还原反应中,获得电子的物质称作氧化剂,与此对应,失去电子的物质称作还原剂。狭义地说,氧化剂又可以指可以使另一物质得到氧的物质,以此类推,氟化剂是可以使物质得到氟的物质,氯化剂、溴化剂等亦然.(注:这两种定义有不同,前者强调电子的得失,后者则强调氧元素的得失。根据前者定义,一些物质,如二氟化氙是强氧化剂,而根据后者定义,则为氟化剂。本词条主要描述前者。)含有容易得到电子元素的物质,即氧化性强的物质常用氧化剂。
氧化剂_氧化剂 -化学性质
氧化剂氧化剂具有的得电子的性质称为氧化性,氧化性的决定因素是该物质中高价态元素的得电子倾向。在溶液中,根据双电层理论,氧化性的大小反映为氧化剂的标准氢电极电势:电势越高,则氧化性越强;电势越低,则氧化性越弱,相对应的,其还原态的还原性则越强。在水中,大部分氧化剂的氧化反应分为三个步骤:解离,亲和,合。这三步决定了氧化反应半反应的焓,对氧化剂的氧化性有非常大的影响。氢离子也对含氧的氧化剂的氧化性起到非常大的作用,原因是氢离子具有非常大的反极化能力,使得X-O键不稳定(X指氧化剂中心原子)。因此一般在酸性条件下,含氧化剂的氧化性比其在碱性时强。对于一些不受氢离子影响的物种,如Cl2,Br2等,其氧化性则与pH无关。另外,氧化剂的氧化性还受到分子对称性的影响,一般分子越对称越稳定,如高氯酸在水中完全电离出高氯酸根,其对称性相当好,使得高氯酸根在水中的氧化性并不是很强。因此对于金属含氧酸,一般是高价态氧化性不如低价态。
氧化剂_氧化剂 -基本分类
根据物质的得电子能力强弱,可将其分为强氧化剂、中等强度氧化剂与弱氧化剂,以大致描述其在氧化还原反应中的表现。然而这个分类的界线是模糊的,有时以氧气(O2/H2O,E?=1.229V[2])和铁离子(Fe3+/Fe2+,E?=0.771V)为界,氧化性超过氧气的物种为强氧化剂,弱于铁离子的为弱氧化剂,介于两者之间的为中等强度氧化剂。按其危险性大小,分为一级氧化剂和二级氧化剂。
氧化剂按照化学组成分为无机氧化剂和有机氧化剂。又可按照氧化反应所要求的介质分为以下3类:
(1)酸性介质氧化剂(过氧化氢、过氧乙酸、重铬酸钠、铬酸、硝酸、高锰酸钾、过硫酸铵)。
(2)碱性介质氧化剂(次氯酸钠、过碳酸钠、过硼酸钠、过硼酸钾)。
(3)中性氧化剂(溴、碘)。
氧化剂_氧化剂 -应用领域
在冶金中常用氧化剂以去除杂质而提纯所熔炼的金属,如炼钢过程中所用的氧化剂有铁矿石、铁磷、空气或工业纯氧等。在化学电池中,常用氧化剂以去除正极上所放出的氧,称为“去除剂”,如干电池中所用的二氧化锰。在化学工业中,广泛用于多种原料和成品生产。
氧化剂_氧化剂 -常见氧化剂
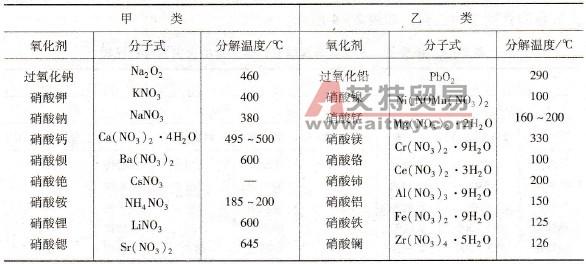
氧化剂常见的氧化剂中,氟气的氧化性最强,相应的,氟离子的还原性最弱,实际上,仅有少数化合物能氧化氟离子生成氟气,且基本为歧化反应。凡品名中有"高"、"重"、“过”字的,如高氯酸盐、高锰酸盐、重铬酸盐,过氧化钠等,都属于此类物质。常见的氧化剂有氧气(或空气)、氯气、重铬酸钠、重铬酸钾、高锰酸钾、硝酸等。常见的这类物质有:氯酸盐:ClO3-;高氯酸盐:ClO4-;无机过氧化物:Na2O2、K2O2、MgO2、CaO2、BaO2、H2O2;硝酸盐:NO3-;高锰酸盐:MnO4-。举例:典型的非金属单质如F2、Cl2、O2、Br2、I2、S、Si等(其氧化性强弱与非金属活动性基本一致);含有变价元素的高价化合物,如KMnO4、KClO3、浓H2SO4、HNO3、MnO2、FeCl3等;金属阳离子如:Fe3+、Cu2+等。
氧化剂_氧化剂 -注意事项
选择氧化剂应当考虑如下几点:(1)氧化效率和用量。(2)与被氧化体系配合性,在反应过程中稳定,不易挥发降低效力,不发生副反应,不影响最终产品的性能。(3)氧化剂本身在储存过程中不易变质失效。(4)使用复合氧化剂制得的胶黏剂明显优于单一氧化剂的作用。(5)低毒安全,不损害健康,不污染环境。(6)价廉易得。
 爱华网
爱华网