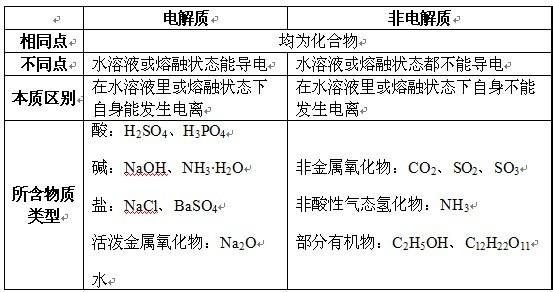
概念:在水溶液或熔融状态下完全电离出离子的电解质。电离程度:完全电离,不存在电离平衡。溶质微粒:只有离子。实例:强酸 HCl、HNO3、H2SO4、HBr、HI等强碱 KOH、NaOH、Ba(OH)2、Ca(OH)2等:绝大多数盐。电解质一般可分为强电解质和弱电解质,两者的导电能力差别很大。可以认为强电解质在溶液中全部以离子的形态存在,即不存在电解质的“分子”(至少在稀溶液范围内属于这类情况)。
强电解质_强电解质 -简介
电解质一般可分为强电解质和弱电解质,两者的导电能力差别很大。可以认为强电解质在溶电解质液中全部以离子的形态存在,即不存在电解质的“分子”(至少在稀溶液范围内属于这类情况)。由于浓度增加时,离子间的静电作用力增加,使离子淌度下降,当量电导也随着下降。对于弱电解质来说,它在溶液中的主要存在形态是分子,它的电离度很小,所以离子数目极少,静电作用也很小,可以认为离子淌度基本上不随浓度而变,因此当量电导随浓度增加而迅速下降的原因主要是电离度的很快下降。
以上分类只是指两种极端的情况,实际体系并不这样简单,例如大部分较浓的强电解质溶液的正、负离子将因静电作用而发生缔合,使有效的离子数减少,促使当导电量下降。
原理
事实上,1887年S.A.阿伦尼乌斯发表的电离理论是按照上述弱电解质的模型提出的,他认为电解质在无限稀释的条件下是100%电离的。设此时的当量电导为Λ0,则任何浓度下的电离度α都可以根据该浓度下测得的当量电导Λ来计算:
从而求出该电解质在溶液中的电离常数K。电离理论应用于乙酸、氨水等弱电解质时取得很大的成功,但在用于强电解质时遇到了困难。直到20世纪20年代,P.德拜和L.昂萨格等发展了强电解质稀溶液的静电理论,才对电解质溶液的本质有了较全面的认识。
根据上述强电解质溶液的模型和物质当量的定义,以及溶液的总电导率是正、负离子各自电导率的和这一性质(见离子淌度),可得:
Ceq=C+|Z+|=C-|Z-|
Λ=(U++U-)F
式中Z+和Z-为正、负离子的价数;C+和C-是正、负离子的浓度;Ceq为当量浓度;U+和U-是正、负离子的离子淌度;F为法拉第常数。如果Λ+和Λ-分别代表1当量正离子和1当量负离子的导电能力,则Λ=Λ++Λ-,Λ+=U+F,Λ-=U-F。
1926~1928年,昂萨格认为溶液浓度增加时,离子间距离缩短,静电作用增强,他应用静电理论得到在极稀浓度范围内强电解质溶液的电导公式:
式中A为常数,图中也说明了溶液的当量电导与当量浓度的平方根呈线性关系。这一点与F.W.G.科尔劳施的精确电导测量结果完全符合,甚至昂萨格的电导公式中的常数A也与实验测得的斜率相同,说明在极稀溶液范围内(对盐酸和氯化钾等对称的一价离子电解质来说,在<0.01N范围内适用),上述强电解质模型是反映实际的。上式中的Λ0是外推法得到的C→0时的当量电导,相当于无限稀释时的当量电导。此时离子间的距离足够远,可以认为各种离子是独立移动的,静电力不起作用。
强电解质和弱电解质
如果把Λ+=U+F和Λ-=U-F改写成Λ+,0=U+,0F和Λ-,0=U-,0F,式中附加在Λ+和Λ-中的下标0表示它们是在无限稀释条件下的当量电导,于是,不管电解质中对应的离子是什么,U+,0和U-,0都应有独自的固定的数值。这就是科尔劳施根据实验提出的无限稀释条件下离子独立移动定律。
在水溶液中或在熔融状态下全部电离成离子的电解质。强酸、强碱、部分碱性氧化物、大部分盐类以及强酸酸式根都是强电解质。
离子化合物和某些具有极性键的共价化合物在水溶液里全部电离成为离子,没有分子存在,所以,不存在分子和离子之间的电离平衡。这样的电解质属于强电解质。强电解质在水溶液里全部电离为离子。如强酸及其酸式根、强碱和大部分盐类是强电解质。
强电解质_强电解质 -分类
电解质的强弱没有绝对的划分标准,强弱电解质之间并无严格的界限。通常所说的电解质强弱是按其电离度大小划分的,能够在水中全部电离的电解质叫强电解质,相反,能够在水中部分电离的电解质叫弱电解质。所以,已溶解于水的电解质是否完全电离是区别强电解质和弱电解质的唯一依据。
强电解质,是指通常情况下,电离度在30%以上的电解质,如强酸及其酸式根、强碱和大部分盐。
因电离常数与温度有关,而与浓度无关,所以有时还用电离常数来比较酸、碱电离能力的大小。通常认为某酸或碱的电离常数K(25℃)大于1为强酸或强碱,即强电解质。可见,强弱电解质之间还存在一系列中间状态的电解质。
有些电解质分步电离,第一步为完全电离,而第二、三步电离又不完全,具有弱电解质的性质。例如,硫酸一级电离几乎完全,二级电离则不完全,电离常数为1.2×10-2,具有中强酸的特征。但硫酸仍是强酸,因一级电离常数K>1。
强电解质_强电解质 -特征
因同一电解质在浓溶液中电离度小,表现为弱电解质的性质;而在稀溶液中电离度大,表现为强电解质的性质。于是,依电离度大小来划分强、弱电解质,对同一电解质随浓度而变,将可能为强电解质,亦可能为弱电解质。为统一起见,一般以物质的量浓度0.1mol・L-1为标准。同一电解质在不同溶剂中也可表现出完全不同的性质。如,食盐在水中为强电解质,而在极性弱的溶剂,如甲醇中,则为弱电解质。一般情况下所谓的强、弱电解质均对水溶液而言。
由于其状态不同,性质也不同。
在水溶液中,强电解质的区分不是靠它的溶解度,而是它溶解部分的电离情况.如BaSO4,它在水中难溶,但它属于强电解质,因为它溶于水的那一部分是完全电离的
强电解质_强电解质 -案例
在水中能完全电离或在熔融状态下能导电的电解质,强酸(硫酸、盐酸、硝酸等)、强碱(氢氧化钠、氢氧化钾等)、大部分正盐(氯化钠、硝酸银、碳酸钾等)都是强电解质。但是强电解质在水中不一定是完全溶解的,因为其定义为“在水中完全电离”,只要此物质在水中溶解的部分完全电离了,就说明它是强电解质,所以,硫酸钡、氯化银等难溶物质都是强电解质。这点请稍微注意一下。
强电解质:所有盐(高中阶段),三大强酸(高中阶段无机强酸只要求这些,有机强酸只作了解,有三硝基苯酚(苦味酸)等),以及碱金属、碱土金属形成的碱(氢氧化锂、氢氧化镁是中强碱,氢氧化铍是两性的除外)
强电解质和弱电解质并不能作为物质的类别,而仅仅是电解质的分类。强电解质在水溶液中只有离子存在,弱电解质在水溶液中既有分子存在又有离子存在。
 爱华网
爱华网
