氢的同位素_氢同位素 -基本信息
hydrogen isotope分类
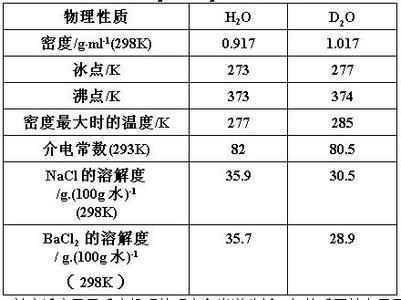
自然界中氢以1H(氕,H),2H(氘,D),3H(氚,T)三种同位素的形式存在,相对丰度分别为约99.985%,约0.015%,低于0.001%,其中氚具放射性,半衰期为12.33年。标准
天然物质的氢同位素组成由D/H比值确定的δ(D)表示,以标准平均海洋水(SMOW)作为标准品。利用
在地球科学中氢同位素通常与氧同位素或碳同位素配合,研究大气降水的成岩成矿作用及石油与天然气的成因。可用于热核反应和标记化合物等。工业生产
液氢精馏、水电解或重水分解均可大规模制氘。液氖吸收法制氘的成本可与液氢精馏法相比。吸附分离与色谱分离是小规模制氘的好方法。利用像热扩散塔中实行自然对流的电泳法,设备简单、能耗小,预计可以以硫化氢双温交换过程(GS过程)竞争。激光分离氢同位素是很有希望的方法。采用氟化氘-水激光分离体系,投资比GS过程节约80%~90%,操作费用节约5/6,已接近实现工业生产水平。氢的同位素_氢同位素 -简介
氕〈名〉piē原子质量为1的普通的轻氢同位素
氕piē氢的同位素之一,符号H。质量数1。它是氢的主要成分。
氘 <名>dāo
氢的同位素,其原子量为普通轻氢的二倍,少量的存在于天然水中,用于核反应,并在化学和生物学的研究工作中作示踪原子
氘dāo 1.氢的同位素之一。符号冈或D
氚〈名〉chuān
氢的放射性同位素,原子量为普通氢的三倍,半衰期12.5年,蜕变时放出β射线后形成质量数为三的氦。用中子轰击锂可产生氚
氚chuān氢的同位素之一,即"超重氢"。符号T,质量数3。具有放射性。自然界中存在极微,从核反应制得。主要用于热核反应。
氢的同位素_氢同位素 -氢-4
氢4-是氢的同位素之一,它包含了质子和三个中子。在实验室里,是用氘的原子核来轰炸氚的原子核,来合成一个氢4的原子核。在这过程中,氚的原子核会从氘的原子核上吸收一个中子。氢4的质量为4.0279121U,半衰期为9.93696x10秒。氢的同位素_氢同位素 -氢-5
氢-5是氢的同位素之一,它的原子核包含了四个中子和一个质子,在实验室里用一个氚的原子核来轰炸氚,这让氚吸收两个氚原子核的质子而形成了氢5。氢5的半衰期非常短,只有8.01930×10秒。氢的同位素_氢同位素 -氢-6
氢-6不稳定的氢同位素之一,它包含了一个质子和五个中子,半衰期为3×10秒 。
氢的同位素_氢同位素 -氢-7
氢-7不稳定的氢同位素之一,它包含了一个质子和六个中子。氢的同位素_氢同位素 -图表
符号Z(p)N(n)原子质量单位(u)半衰期原子核自旋丰度丰度的变化率1H101.00782503207(10)稳定 [>2.8×1023 年]1/2+0.999885(70)0.999816-0.9999742H112.0141017778(4)稳定1+0.000115(70)0.000026-0.0001843H123.0160492777(25)12.32(2) 年1/2+4H134.02781(11)1.39(10)×10-22 s [4.6(9) MeV]2-
5H145.03531(11)>9.1×10-22 s ?(1/2+)
6H156.04494(28)2.90(70)×10-22 s [1.6(4) MeV]2-#
7H167.05275(108)#2.3(6)×10-23# s [20(5)# MeV]1/2+#
备注:画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
 爱华网
爱华网