谷氨酸受体_谷氨酸受体 -种类
谷氨酸受体分为两类:一类为离子型受体,包括:N-甲基-D-天冬氨酸受体(NMDAR)、海人藻酸受体(KAR)和α-氨基-3 羟基-5 甲基-4 异恶唑受体(AMPAR),它们与离子通道偶联,形成受体通道复合物,介导快信号传递;另一类属于代谢型受体(mGluRs),它与膜内G-蛋白偶联,这些受体被激活后通过G-蛋白效应酶、脑内第二信使等组成的信号转导系统起作用,产生较缓慢的生理反应。离子型受体
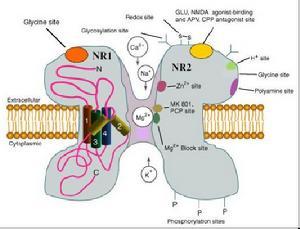
(1) NMDA 受体(NRs):其与突触的可塑性和学习记忆密切相关。通过该受体本身、其共轭的离子通道及调节部位3 者形成的复合体而发挥功能,对Ca2+高度通透。每个NMDA 受体上含有两个谷氨酸和两个甘氨酸结合识别位点,谷氨酸和甘氨酸均是受体的特异性激活剂。到目前为止已克隆出5个亚基,NMDAR1、NMDAR2(A-D)其中NMDAR1 可单独形成功能性纯寡聚体NMDAR,但NMDAR2 亚基却不具备该功能。有研究表明NMDAR可能是由NMDAR1 和NMDAR2 不同的亚基组成的一个异寡聚体。
(2) KA/AMPA 受体:它们也是受配基调控的离子通道,对Na+、K+有通透性,研究证明,一些受体亚型对Ca2+也有通透性。AMPA 家族包括4 个结构极为相似的亚基GLUR1-4,各亚基的氨基酸序列的同源性高达70%。由于氨基酸残基的疏水性分布,在靠近羧基端的部分构成4 个跨膜区。AMPA、L-谷氨酸及KA 均可激活这类离子
通道,并有AMPA 的高亲和力结合位点。天然的AMPAR 是由这4 种亚基形成的四聚体。每个单位的分子量为108kd。AMPA 受体的4 种亚基在第4 个跨膜区上游均含有1 个由38 个氨基酸残基组成的特殊区段,该区存在2 个结构相似区,分别由受体基因上的2 个相临的外显子编码。但各亚基的DNA 编码在翻译后要经过一些如:磷酸化、糖基化等修饰,这些修饰是通道功能的重要调节方式。离子型谷氨酸受体功能的多样性是通过不同亚基组装、选择性基因结合和转录前mRNA 的编辑等方式来实现的。
在大鼠中通过分子克隆技术,已发现5 种KA 受体亚型(GLUR5-7、KA-1、KA-2),利用逆转录PCR 及膜片钳技术揭示:KA 受体是由同类的不同亚基组成的异质组合体。亚基的组成对受体的功能和特性影响特别大,因为异质的KA 复合物中出现编辑的GLUR5 或GLUR6 会阻碍Ca2+的通透性。细胞可能通过 RNA 编辑改变结构,达到调控通道的Ca2+流量。
代谢型谷氨酸受体(mGLuRs)
这是通过G-蛋白偶联,调节细胞内第二信使的产生而导致代谢改变的谷氨酸受体,其可分为不同的8 个亚型mGLUR1-8,根据氨基酸序列的同源性及其药理学特征和信号转导机制的不同,可将其分为3 组,ⅠmGLUR1、mGLUR5; Ⅱ mGLUR2-3; Ⅲ mGLUR4、mGLUR6-8。Ⅰ组可被Quis 强烈活化并与磷脂酶C途径(PLC)相偶联;Ⅱ、Ⅲ组均可与腺苷酸环化酶系统(AC)被动偶联。
谷氨酸受体_谷氨酸受体 -相关论文
D-Ser-NMDA受体的一种新的调控因子 陈福俊
陈福俊,何德富,周绍慈
(华东师范大学上海市脑功能基因组学重点实验室,上海 200062)
摘要:最近研究证实哺乳动物神经系统中存在内源性的D-Ser。这种内源性D-Ser在神经系统中的分布与NMDA受体的分布相平行,进一步的研究表明,D-Ser由突触旁星形胶质细胞产生,而作用于突触后NMDA受体上的Gly结合位点,对NMDA受体的功能进行调控。本文将综述D-Ser在神经系统中的分布、合成及其生理机能。
Abstract: The viewpoint that there is no endogenous D-serine in mammalian nervous system has changed based on recent published reports. The study indicated that the distribution of this kind of endogenous D-serine parallels with that of NMDA receptor in nervous system. Further study suggested that the D-serine produced in astrocytes regulates the function of NMDA receptor through the glycine-binding site of the receptor. This paper reviews the distribution, synthesis and physiological function of D-serine in nervous system.
NMDA受体(N-methyl-D-aspartate receptor)是中枢神经系统内一类重要的兴奋性氨基酸(excitatory aminoacid, EAA)受体。NMDA受体不仅在神经系统发育过程中发挥着重要的生理作用,如可调节神经元的存活,调节神经元树突、轴突结构发育及参与突触可塑性的形成等;在神经元回路的形成中NMDA受体亦起着关键作用,有资料表明NMDA受体是学习与记忆过程中一类至关重要的受体[1]。NMDA受体受多种因子的调控,而最近发现了NMDA受体的一种特别的调控因子――D型丝氨酸(D-Serine,D-Ser)[2]。D-Ser这种新的神经调质的发现引起了神经科学界极大关注,本文将综述这方面的最新进展。
自然界中存在的氨基酸绝大多数都有两种构型:L型和D型。构成生物体中蛋白质的氨基酸通常都为L型,在细菌和无脊椎动物体内曾发现有内源性的D型氨基酸[3],而对于哺乳动物体内存在D型氨基酸的事实,过去普遍把它归结于食物来源或肠内的细菌所产生[3,4]。早期研究认为,哺乳动物体内不能产生D型氨基酸,因为氨基酸消旋酶只发现在细菌和昆虫体内,而在哺乳动物体内还未分离纯化出这种酶。然而最近的研究报告表明在哺乳动物神经系统中存在自由D-Ser和D-天冬氨酸(D-aspartate, D-Asp)[5,6];另有研究报告报道,大鼠额叶和顶叶皮层突触体中的磷酸丝氨酸磷酸化酶(phosphoserine phosphatase)可水解L-磷酸丝氨酸(L-phosphoserine),最终生成L-Ser和D-Ser[7]。因而这类D型氨基酸在神经系统中的生理作用,很自然地引起了神经科学工作者的广泛关注。下面将重点阐述D-Ser在神经系统中的分布、合成及生理机能。
自有报道说在哺乳动物中枢神经系统中存在自由的D型氨基酸以来,许多科学家便把注意力转向这类不参与构成生物体内蛋白质的氨基酸上来。采用对D-Ser具有高度选择性的抗体,利用免疫组化的方法研究发现,D-Ser主要存在于哺乳动物脑内灰质区中的Ⅱ型星形胶质细胞内,这种胶质细胞多位于突触旁边[2,8]。D-Ser分布的主要脑区为前额叶皮层和纹状体,小脑中也有微量分布[9]。令人感兴趣的是,在哺乳动物中,NMDA受体分布密度最高的是海马的CA1区、CA3区和齿状回,大脑皮层区的前脑皮层、前扣带区和梨状皮层,此外,在纹状体、丘脑、小脑颗粒细胞层也有较多分布[10]。在D-Ser存在的脑区中,往往存在着大量的NMDA受体,二者的分布存在着一种平行关系。
NMDA受体是一种独特的双重门控通道(doubly gated channel),它既受膜电位控制也受其它神经递质控制。NMDA受体被激活后,主要对Ca2+有通透性,介导持续、缓慢的去极化过程。在突触传递过程中,NMDA受体的激活需要非NMDA受体的参与,其中主要是AMPA受体(α-amino-3-hydroxy-5-methyl-4-isoxazole propionate receptor)的参与。当刺激达到一定强度时,突触前膜释放的谷氨酸作用于AMPA受体,通过AMPA受体通道的离子流增强,使得邻近NMDA受体的突触后膜局部去极化,进而导致NMDA受体通道Mg2+阻断的释放,这时谷氨酸与NMDA受体的结合便可使通道打开。此外当有甘氨酸结合到甘氨酸结合位点时,通过变构调控可以大大增强谷氨酸作用于NMDA受体后所产生的效应,另外多聚胺可增强谷氨酸对NMDA受体的作用,而Zn2+却可以抑制多聚胺的这种作用。可见,NMDA受体的激活受多种因子的调控。
D-Ser与NMDA受体的共分布现象,促使科学家进一步对二者的功能联系进行研究。最近的研究发现D-Ser是NMDA受体的一种新的独特的调质。Ascher等人研究发现,在用快速灌流制备的神经标本中,NMDA受体的活性会暂时丧失,但这种活性的暂时丧失可为甘氨酸所逆转[11]。进一步的研究表明NMDA受体上存在Gly结合位点,而NMDA受体的活化需要Gly位点的共激活[7]。但让人不解的是,在中枢神经系统中Gly的浓度在前脑是最低的,而前脑中NMDA受体的含量却很高;相反在脊髓和后脑中Gly的含量最高,但在这些区域Gly却发挥着一种抑制性神经递质的作用。有研究报告显示在NMDA受体分布的灰质脑区中,D-Ser的含量约为Gly的3倍[12-14],在前额叶皮层,胞外D-Ser的量与Gly相当,在纹状体D-Ser的含量约是Gly的2倍[10]。另外的研究证实,施加外源性的D-Ser可以增强NMDA受体调节的神经传递作用。此外采用放射性同位素3H标记D-Ser研究发现,D-Ser选择性结合于Gly结合位点[15]。大量实验结果表明,D-Ser对NMDA受体似乎与Gly有着类似的作用,D-Ser也是NMDA受体上Gly位点的一种内源性配基。进一步的研究则惊人的发现D-Ser是由突触旁星型胶质细胞产生而作用于突触后神经元上NMDA受体的。如Fig.
1所示,当突触前膜兴奋时,释放兴奋性氨基酸递质谷氨酸到突触间隙,其中一部分Glu作用于突触后膜上的NMDA受体,另一部分则扩散到了邻近的星形胶质细胞,作用于其上的非NMDA受体,后者的激活导致贮存于胞浆中的D-Ser由星形胶质细胞释放出,然后结合于突触后膜上的NMDA受体[16],从而与Glu共同作用,激活NMDA受体。
Fig. 1 The active mechanism of D-serine(cited from Snyder SH, revised partly)
而D-Ser的清除和灭活则依赖于D型氨基酸氧化酶,在三十年代便发现哺乳动物体内存在D型氨基酸氧化酶[17],但对其作用一直没有定论。D型氨基酸氧化酶是一种高度选择性的酶,只降解中性D型氨基酸。Snyder等采用组织化学的方法研究发现,D型氨基酸氧化酶在脑内的分布存在区域差异,其浓度与D-Ser的分布相平行[2]。在生理条件下D型氨基酸氧化酶的最佳底物是D-Ser和D-丙氨酸,在脑片实验中也证实了D型氨基酸氧化酶可降低NMDA受体的神经传递作用,而对Gly和D-Asp无明显影响,表现出对D-Ser的高度选择性[13]。可见通过D型氨基酸氧化酶的作用可及时清除释放入突触间隙的多余的D-Ser,以防止其持续作用于NMDA受体,从而维持了NMDA受体的正常生理功能。
D-氨基酸的产生依赖氨基酸消旋酶,胞内是否存在专一的丝氨酸消旋酶呢?Snyder等的工作使这一问题获得了圆满的解答,他们从大鼠脑内分离出一种氨基酸消旋酶,这种消旋酶专一催化L-Ser转化为D-Ser,遂将其命名为丝氨酸消旋酶(serine rasemase)。丝氨酸消旋酶由339个氨基酸残基组成,分子量为36.3KD。尔后他们通过分析丝氨酸消旋酶的结构和检索基因库后,得出这一酶的全序列cDNA,并在体外进行了表达,而且成功地在培养细胞中合成了D-Ser。免疫组化研究表明,这种丝氨酸消旋酶大量存在于前脑及灰质区的Ⅱ型星形胶质细胞中,而这里正是NMDA受体和D-Ser分布广泛的脑区[18]。这也进一步说明D-Ser是生物体内源性的物质。
以往被认同的神经递质和神经调质都是由突触前膜或突触后膜产生,作用于突触前膜或突触后膜上的受体,而D-Ser这种独特的神经调质则是由突触旁的神经胶质细胞产生作用于突触后膜上的NMDA受体,这就使我们想到脑内数量远多于神经元的神经胶质细胞,除了能高亲和性地吸收GABA并将其灭活,通过细胞间液的物质交流参与神经元内Glu和GABA的代谢,影响神经肽的合成及传统的支持、营养、修复、吞噬诸多功能外[19],还可能参与神经兴奋性传导和调制等机能。
D-Ser作用机制的发现不仅具有重要的理论意义,而且在医学应用方面也预示着广阔的前景。这主要表现在它为神经疾病的治疗提供了一个新的作用靶,例如谷氨酸浓度升高可加重帕金森病、阿尔茨海默病和亨廷顿病的症状,只要阻断了Glu的作用必定会缓解这些疾病的症状,现在就可以考虑应用D-Ser的阻断剂来达到同样的治疗目的。在夏科氏综合症(ALS)与帕金森病的动物模型中丝氨酸消旋酶的抑制剂与Glu受体的拮抗剂有着相同的疗效,所以利用D-Ser对NMDA受体的调控作用也可以作为治疗一些神经疾病的新途径,如焦虑、癫痫、中风及精神分裂症等疾病的治疗都可以考虑应用D-Ser这种手性药物。
 爱华网
爱华网