溶解度,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。在这里要注意:如果没有指明溶剂,通常所说的溶解度就是物质在水里的溶解度。溶解度的单位是克(或者是克/100克溶剂)而不是没有单位。
溶解度仪溶解度,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。在这里要注意:如果没有指明溶剂,通常所说的溶解度就是物质在水里的溶解度。溶解性是指一种物质能够被溶解的程度。发生溶解的物质叫溶质,溶解他物的液体(一般过量)叫溶剂,或称分散剂,生成的混合物叫溶液。固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。在未注明的情况下,通常溶解度指的是物质在水里的溶解度。气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积水里的体积数。溶解度是指在一定的温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的克数。特别注意:溶解度的单位是克(或者是克/100克水)而不是没有单位。
溶解度_溶解度 -简介概要
二氧化碳的溶解度随温度高低变化在一定的温度和压力下,物质在一定量的溶剂中溶解的最高量。一般以 100克溶剂中能溶解物质的克数来表示。一种物质在某种溶剂中的溶解度主要决定于溶剂和溶质的性质。例如,水是最普通最常用的溶剂,甲醇和乙醇可以任何比例与水互溶。大多数碱金属盐类都可以溶于水;苯几乎不溶于水。溶解度明显受温度的影响,大多数固体物质的溶解度随温度的升高而增大;气体物质的溶解度则与此相反,随温度的升高而降低。 溶解度与温度的依赖关系可以用溶解度曲线来表示。氯化钠NaCL的溶解度随温度的升高而缓慢增大,硝酸钾KNO3的溶解度随温度的升高而迅速增大,而硫酸钠Na2SO4的溶解度却随温度的升高而减小。固体和液体的溶解度基本不受压力的影响,而气体在液体中的溶解度与气体的分压成正比。 物质的溶解度对于化学和化学工业都很重要,在固体物质的重结晶和分级结晶、化学物质的制备和分离、混合气体的分离等工艺中都要利用物质溶解度的差别。
在一定温度下,某物质在100g溶剂里达到饱和状态(或称溶解平衡)时所溶解的克数,叫做这种物质在这种溶剂里的溶解度。在一定温度和压强下,物质在一定量的溶剂中溶解的最大量,叫做这种物质在这种溶剂里的溶解度。溶解度和溶解性溶解性是一种物质在另一种物质中的溶解能力,通常用易溶、可溶、微溶、难溶或不溶等粗略的概念来表示。溶解度是衡量物质在溶剂里溶解性大小的尺度,是溶解性的定量表示。溶解度常用符号S表示。溶解度的单位用g/100gH2O表示。例如20℃,在100g水里最多溶解36gNaCl,则氯化钠在25℃的溶解度是36g/100gH2O,可表示为S(NaCl)=36g/100gH2O。实际上溶解度是没有单位的相对比值,按法定计量单位,可用质量分数表示。例如在20℃,S(NaCl)=0.36。溶解度也可以用饱和溶液的浓度表示。例如,氯化钾在20℃的溶解度是4.627mol/1000gH2O(此浓度为质量摩尔浓度),即表示20℃在1000g水中最多可溶解4.627mol的氯化钾。难溶物质的溶解度也可以用物质的量浓度(摩尔浓度)表示。例如在25℃,氢氧化铁的物质的量浓度是0.45μmol/L,即表示1L氢氧化铁饱和溶液里含0.45μmol氢氧化铁。多数固体物质的溶解度随温度的上升而增大,如氯化铵、硝酸钾。少数物质的溶解度受温度变化的影响很小,如氯化钠。含有结晶水的硫酸钠(Na2SO4・10H2O)的溶解度开始随温度的升高而增大,当达到一定温度(32.4℃)时,随温度的升高而减小(这时Na2SO4・10H2O脱水成Na2SO4)。含有结晶水的氢氧化钙[Ca(OH)2・2H2O]和醋酸钙[Ca(CH3COO)2・2H2O]等物质的溶解度随温度的升高而减小。气体的溶解度随温度的升高而减小,随压强的增大而增大。
溶解度_溶解度 -意义应用
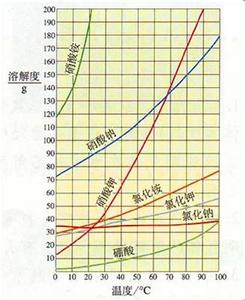
溶解度曲线的意义与应用可从点、线、面和交点四方面来分析。
溶解图片1、点
溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。即曲线上的任意一点都对应有相应的温度和溶解度。温度在横坐标上可以找到,溶解度在纵坐标上可以找到。溶解度曲线上的点有三个方面的作用:(1)根据已知温度查出有关物质的溶解度;(2)根据物质的溶解度查出对应的温度;(3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2、线
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用:
1、根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。
2、根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小。
3、根据溶解度曲线,选择分离某些可溶性混合物的方法。
3、面
对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
4、交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
溶解度_溶解度 -溶解平衡
溶解度每份(通常是每份质量)溶剂(有时可能是溶液)所能溶解的溶质的量的最大值就是溶质在这种溶剂的溶解度。如果不指明溶剂,通常意味着溶剂为水,比如“氯化钠的溶解度”和“氯化钠在水中的溶解度”可以认为是具有同样的意思。溶解度并不是一个恒定的值。一种溶质在溶剂中的溶解度由它们的分子间作用力、温度、溶解过程中所伴随的熵的变化以及其他物质的存在及多少,有时还与气压或气体溶质的分压有关。因此,一种物质的溶解度最好能够表述成:“在某温度,某气压下,某物质在某物质中的溶解度为xxxx。”,如无指明,则温度及气压通常指的是标准状况(STP)。实际上,溶解度往往取决于溶质在水中的溶解平衡常数。这是平衡常数的一种,反映溶质的溶解-沉淀平衡关系,当然它也可以用于沉淀过程(那时它叫溶度积)。因此,溶解度与温度关系很大,也就不难解释了。达到化学平衡的溶液便不能容纳更多的溶质(当然,其他溶质仍能溶解),我们称之为饱和溶液。在特殊条件下,溶液中溶解的溶质会比正常情况多,这时它便成为过饱和溶液。
在一定温度和压力下,物质在一定量溶剂中溶解的最大量。固体或液体溶质的溶解度,常用100克溶剂中所溶解的溶质克数表示。例如在20℃和常压下,硝酸钾在水中的溶解度是31.5克/100克水,或简称31.5克。气体溶质的溶解度,常用每毫升溶剂中所溶解的气体毫升数表示。例如在20℃和常压下,氨的溶解度是700毫升/1毫升水。物质的溶解度除与溶质和溶剂的性质有关外,还与温度、压力等条件有关。随着温度的升高,大多数固体和液体的溶解度增大,气体的则减小。随着压力的增大,气全的溶解度增。
溶解度_溶解度 -溶解曲线
溶解度1、溶解度曲线上每一点表示该物质在不同温度下的不同的溶解度。
2、溶解度曲线上的任意一点表示在该温度下某物质的溶解度是多少克。
3、不同物质溶解度曲线的交点处,表示不同物质在相对应的同一温度下的溶解度相同。
4、溶解度曲线上方的一点,表示在指定温度下,溶液中的溶质质量已超过该物质的溶解度,溶液是过饱和的;溶解度曲线下方的一点,表示在指定温度下,溶液中溶质质量还没有达到溶解度的量,溶液是不饱和的。
溶解度_溶解度 -曲线特征
溶解度曲线
1.大多数固体物质的溶解度随温度升高而增大,曲线为“陡升型”,如。
2.少数固体物质的溶解度受温度的影响很小,曲线为“缓升型”,如。
3.极少数固体物质的溶解度随温度的升高而减小,曲线为“下降型”,如。
4.气体物质的溶解度均随温度的升高而减小(纵坐标表示体积),曲线也为“下降型”,如氧气。
溶解度_溶解度 -曲线运用
溶解度1、由已知温度查某物质对应的溶解度;
2、由物质的溶解度查该物质所处的温度;
3、比较同一温度下不同物质的溶解度;
4、设计混合物分离或提纯的方法,例如提纯NaCl可用蒸发溶剂法,分离NaCl和NaNO3可用降温结晶法。
溶解度_溶解度 -影响因素
溶解度物质溶解与否,溶解能力的大小,一方面决定于物质的本性;另一方面也与外界条件如温度、压强、溶剂种类等有关。在相同条件下,有些物质易于溶解,而有些物质则难于溶解,即不同物质在同一溶剂里溶解能力不同。通常把某一物质溶解在另一物质里的能力称为溶解性。例如,糖易溶于水,而油脂不溶于水,就是它们对水的溶解性不同。溶解度是溶解性的定量表示。
固体物质的溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的克数。在未注明的情况下,通常溶解度指的是物质在水里的溶解度。如20℃时,食盐的溶解度是36克,氯化钾的溶解度是34克。这些数据可以说明20℃时,食盐和氯化钾在100克水里最大的溶解量分别为36克和34克;也说明在此温度下,食盐在水中比氯化钾的溶解能力强。
通常把在室温(20度)下,溶解度在10g/100g水以上的物质叫易溶物质,溶解度在1~10g/100g水叫可溶物质,溶解度在0.01g~1g/100g水的物质叫微溶物质,溶解度小于0.01g/100g水的物质叫难溶物质。可见溶解是绝对的,不溶解是相对的,气体的溶解度还和压强有关。压强越大,溶解度越大,反之则越小。温度越高,气体溶解度越低。
溶解度_溶解度 -分数计算
溶解度大致包括以下四种类型:
1、已知溶质和溶剂的量,求溶质的质量分数;
2、要配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量;
3、溶液稀释和配制问题的计算;
4、把溶质的质量分数运用于化学方程式的计算。
溶解度_溶解度 -固体溶解度
硝酸钾大部分固体随温度升高溶解度增大,如硝酸钾
少部分固体溶解度受温度影响不大,如食盐(氯化钠)
极少数物质溶解度随温度升高反而减小,如熟石灰(氢氧化钙)。因为氢氧化钙有两种水合物〔Ca(OH)2・2H2O和Ca(OH)2・12H2O〕。这两种水合物的溶解度较大,无水氢氧化钙的溶解度很小。随着温度的升高,这些结晶水合物逐渐变为无水氢氧化钙,所以,氢氧化钙的溶解度就随着温度的升高而减小。
溶解度_溶解度 -气体溶解度
溶解度影响因素内因:气体和水的性质,气体物质的溶解度随压强的增大而增大,随温度的升高而减小溶解度曲线的意义。气体的溶解度有两种表示方法:
1、在一定温度下,气体的压强(或是该气体的分压,不包括水蒸气的压强)在101kPa下,溶解在1体积水里达到饱和状态时溶解的气体的体积(将非标准状况时气体的体积换算成标准状况时的体积数),就是这种气体在水里的溶解度。例如在0℃,氮气的溶解度是0.024,就是指在0℃,1体积水里最多能溶解0.024体积的氮气。
2、在一定温度下,气体的总压强是101kPa(气体的分压加上当时水蒸气的压强)时该气体在100g水里溶解的克数。这种表示方法跟固体溶解度的通常表示方法一致。溶解度的大小跟溶质和溶剂的性质有关,还跟外界条件有关。
定义:压强为101KPa,一定温度时,溶剂在1体积水中达到饱和状态时的气体体积。
外因:温度和压强。
溶解度_溶解度 -溶液的稀释
溶解度根据稀释前后溶质的总量不变进行运算,无论是用水,或是用稀溶液来稀释浓溶液,都可计算。
1、用水稀释浓溶液
设稀释前的浓溶液的质量为m,其溶质的质量分数为a%,稀释时加入水的质量为n,稀释后溶质的质量分数为b%。
则可得m×a%=(m+n)×b%
2、用稀溶液稀释浓溶液
设浓溶液的质量为A,其溶质的质量分数为a%,稀溶液的质量为B,其溶质的质量分数为b%,两液混合后的溶质的质量分数为c%。
则可得A×a%+B×b%=(A+B)×c%(1)
或A/B=(c%-b%)/(a%-c%)(2)
溶解度_溶解度 -相关词条
焰色反应阿伏伽德罗常数空气化学元素周期表氢离子浓度指数工业盐溶解度_溶解度 -参考资料
1、http://www.cqvip.com/asp/vipsearch.asp
2、http://www.pep.com.cn/czhhx/jshzhx/jnxc/jxshj/jxdj/200503/t20050308_43921.htm
 爱华网
爱华网