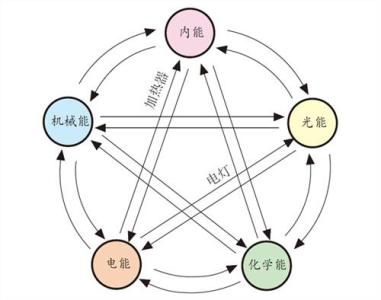
能量既不会凭空产生,也不会凭空消失,只可以从一个物体传递给另一个物体,而且能量的形式也可以互相转换。这就是人们对能量的总结,称为能量守恒定律。它是自然界的一个普遍规律――在自然界的各种变化中,能量既不会无中生有,也不会自行消灭,只会从一种形式转化为另一种形式,而转化时总能量是恒定的。因而,这个原理应完整地称为“能量转化及守恒原理”。例如,力学中的动能与势能互相转化,电化学中在电池里发生的电能与化学能互相转化、尽皆守恒。
能量守恒_能量守恒 -定义
能量在量方面的变化,遵循自然界最普遍、最基本的规律,即能量守恒定律。
注:能量守恒定律:英文名称:lawofenergyconservation定义:各种能量形式互相转换是有方向和条件限制的,能量互相转换时其量值不变,表明能量是不能被创造或消灭的。应用学科:资源科技(一级学科);能源资源学(二级学科)
解释能量既不能被创造,也不能被消灭。能量守衡是物质运动的普遍规律之一。物质运动有各种不同的形式,如机械运动、热、光、电、磁现象和化学变化等,它们之间能相互转化。在转化前后,作为物质运动度量的能量,其总和不变。当涉及高能量(如原子能)的变化问题时,按质能关系式E=mc(式中E为能量;m为质量;c为光速)产生相应的质量变化。但是在化工生产过程中,一般不出现象核反应那样的高能量变化,质量变化可以忽略
研究沿革能量守恒的概念,在力学领域内早已为物理学家所证明。例如物体从高处自由落下时,物体的部分位能转化成动能,因此位能逐渐减小,动能逐渐增大,但在同一瞬间,动能与位能的总和不变。然而,这个守恒概念引伸到热能,则经历了二三百年之久。对于热能,在历史上有过种种错误的认识。从18世纪到19世纪中叶,自然科学界长期被热质论所统治着。这种片面的理论认为物质中存在着一种流体,称为热质。将温度差所引起的传热,视为热质从高温物体流向低温物体;而摩擦生热则认为是热质释放的结果。这个理论与许多实验事实相矛盾。1798年朗福德研制炮筒,观察到产生的热量与钻磨掉的金属屑的量不成比例,而且,如果用钝钻头继续进行钻磨,放出的热量几乎是无限的,这说明热质不可能是一种物质。以后又经过H.戴维、J.R.迈尔、H.亥姆霍兹等的工作,特别是1840~1848年间J.P.焦耳所进行的热功当量实验,人们逐步认识到热质并不存在。热的传递或转化,与机械功及电功等的传递或转化一样,也是一种能量的传递或转化,而在传递或转化时,总能量恒定不变。这样,能量守恒就在普遍的基础上被确认化工应用根据能量守恒法则,可以建立能量衡算,它在科学技术领域中应用甚广,在化工中尤为重要。
系统与环境间的能量守恒在化工生产过程中,系统与环境间有着能量的传递。由于温度差而传递的能量称为“热量”,符号用Q,并规定系统吸热为正值,放热为负值。在除温度差以外的其他推动力的影响下所传递的能量则称为“功”,符号用D,并规定系统对环境做功为正值,得功为负值。例如,由于系统与环境之间存在压力差,使系统体积膨胀而对环境做体积功,其值为正;反之,若使系统体积收缩,则所得的体积功为负值。又如由于系统产生的电动势而发生的电流对环境做电功,为正值;系统接受外电压所做电功则为负值。对于与环境没有物质交换的封闭系统中进行的过程,按照能量守恒,可得以下关系:
U1+Q=U2+W
或ΔU=U2-U1=Q-W(1)
式中U为内能,它是除了整个系统的动能与位能以外,系统内部一切形式能量的总和;U1与U2分别为初态和终态时的内能。式(1)就是热力学第一定律的表达式,它揭示出过程的有关能量项目之间的关系。例如,气体在膨胀过程中与外界环境间的热交换量是难以用实验测定的,而从式Q=ΔU+D可以较容易地求出。对于化工生产中常见的压力恒定的恒压过程,由式(1)可导得:ΔH=H2-H1=Q(2)
式中H为焓,它是内能以及压力p与体积V的乘积之和,即H=U+pV。由式(2)可见,恒压过程的热交换量,只决定于终态与初态的焓差,与实际经历的途径无关。例如碳经过氧化变为二氧化碳,可以是一步氧化,也可先氧化为一氧化碳再进一步氧化为二氧化碳。这些反应表示如下:根据式(2)可得QpⅠ=QpⅡ+QpⅢ,它使我们可以用易于测定的QpⅠ和QpⅢ,求得难以测定的碳被氧化为一氧化碳所放的热QpⅡ。式(2)是封闭系统恒压过程能量衡算的基本公式。连续流动中的能量守恒在化工生产过程中,物料还经常在连续流动的情况下操作,例如连续蒸馏、连续反应过程、流体输送、换热等。并且在许多化工过程和设备中,不涉及除体积功以外的其他功。如果在物料连续流动的流速较慢、动能可忽略不计以及位能的变化也不大的情况下进行,则根据能量守恒法则,可得下列关系:
U1+p1V1+Q=U2+p2V2+ΔE(3)
式中U1与U2分别为流入和流出物料的内能;p1与p2分别为在物料流入处和流出处的压力;V1与V2分别为流入和流出物料的体积;ΔE是设备中能量的积累,能量增加时,ΔE为正值,减少时则为负值。如果是定态流动过程,系统中没有物质和能量的积累,则ΔE=0,于是:U1+p1V1+Q=U2+p2V2
或ΔH=H2-H1=Q(4)
式中H1与H2分别为流入和流出物料的焓。式(4)是定态流动过程热量衡算的基本公式。由于符合式(2)与式(4)条件的化工过程和设备很普遍,所以根据此两式进行的热量衡算在化工生产和设计计算中应用广泛。
能量守恒_能量守恒 -表达形式
保守力学系统
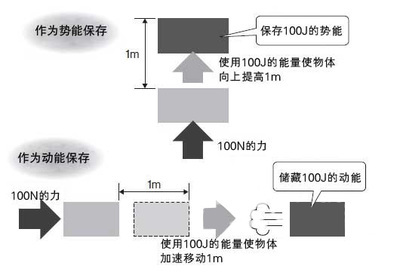
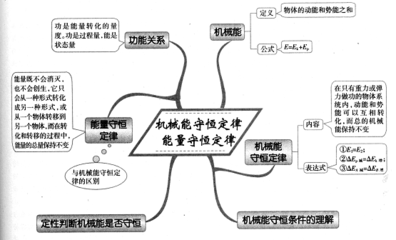
在只有保守力做功的情况下,系统能量表现为机械能,(动能和位能)能量守恒具体表达为机械能守恒定律。热力学系统
能量表达为内能,热量和功,能量守恒的表达形式是热力学第一定律。相对论力学
在相对论里,质量和能量可以相互转变。计及质量改变带来能量变化,能量守恒定律依然成立。历史上也称这种情况下的能量守恒定律为质能守恒定律。流体力学
在流体力学中有一种边界层表面效应,又称"伯努利效应“。是指流体速度加快时,物体与流体接触的界面上的压力会减小,反之压力会增加,伯努利效应是流体力学中的能量守恒定律。伯努利因发现这一现象并成功解释它而创立的流体力学。电磁学
根据楞次定律,感应电流所产生的磁场总是阻碍原磁场磁通量的变化,这种阻碍的结果就使得电磁感应的过程中将其他形式的能量转化为电能,感应电流形成回路,再将电能转化为其他形式的能量。 也就是说,楞次定律所揭示的感应电流与原磁场的关系本质仍然是能量转化的关系,即能量守恒定律。能量守恒_能量守恒 -意义
能量守恒是符合时间平移对称性的,这也就是说能量守恒定律的适用是不受时间限制的,举个例子比如说切割磁感线的闭合线圈在动能损失时增加了其的焦耳内能,这是符合能量守恒定律的,而这个过程即使推后几天也是成立的。
自然科学中最基本的定律之一。它科学地阐明了运动不灭的观点。它可表述为:在孤立系统中,能量从一种形式转换成另一种形式,从一个物体传递到另一个物体,在转换和传递的过程中,各种形式、各个物体的能量的总和保持不变。整个自然界也可看成一个孤立系统,而表述为自然界中能量可不断转换和传递,但总量保持不变。
从18世纪末到20世纪40年代,6个国家的10多位科学家从不同角度或否定热质说或独立地提出了能量守恒观点。俄国化学家盖斯于1836年发现,任何一个化学反应,不论是一步完成,还是几步完成,放出的总热量相同,即证明了能量在化学反应中是守恒的,被认为是能量守恒定律的先驱。德国医生J.R.迈尔在荷兰远航东印度船中任船医时,在热带地区看到海员静脉中的血红于在欧洲时,他联系到L.A.拉瓦锡的燃烧理论,认为机体需热量小,食物氧化过程减弱,静脉血中留下较多的氧,从而想到食物中化学能与热能的等效性。又从海员谈话中听到海水在暴风雨中较热,想到热和机械运动的等效性,1841和1842年连续写出论自然力(即能量)守恒的论文,并从空气的定压和定容比热之比,推算出热功当量为1卡等于365克力・米,因此迈尔是公认的第一个提出能量守恒并计算出热功当量的人。J.P.焦耳是英国的酒商和业余的物理学家,从1837年开始研究电流产生热量,以后又用多种机械装置反复测定热功当量,一直工作到1878年,终于精确地测定了热功当量值(他用的是英制,换算后为4.51焦/卡),和现代值很近,从而为能量守恒奠定了巩固的实验基础,因此也被公认为发现人之一。德国生理学家H.von亥姆霍兹在不了解迈尔和焦耳的研究情况下,从永动机不可能出发,思考自然界不同的力(即能)间的相互关系。在专著《力的守恒》中提到张力(今称势能)和活力(即动能)的转换,还深刻地阐明热的本质:“被称为热的量的,一部分是指热运动活力的量,另一部分是指原子之间张力的量。这些张力在原子的排列发生变化时能引起热运动,第一部分相当于称之为自由热的部分,第二部分相当于称之为潜热的部分。”他还分析了在电、磁和生物机体中的力的守恒问题。尽管他系统地完整地综合了能量守恒理论,他仍把发现定律的优先权让给迈尔和焦耳。此外,还有好几位科学家对这条定律做出贡献,但这条揭示力、热、电、化学等各种运动间的统一性、使物理学融为一体的重要定律,在诞生初期却受到重重阻挠。英国皇家学会曾拒绝宣读焦耳的论文,德国主要物理学杂志主编J.C.波根多夫以含有思辨内容为由曾先后拒绝发表迈尔和亥姆霍兹的论文,使得他们不得不以小册子形式自费出版论文。
20世纪,根据A.爱因斯坦的狭义相对论,能量有新的涵义,高速运动的粒子的能量表示式也和宏观、低速运动的物体的表示式有根本差别。实验证明,康普顿效应等高速粒子碰撞现象完全符合能量守恒,而且还能根据这条定律预言在β衰变中出现的新粒子――中微子,因此这条从宏观物理现象总结出来的基本定律完全符合微观粒子的运动,确保了它在自然科学中的重要地位。已知道它是和时间平移对称性相关联的,并和三个方向上的动量守恒,组成了四维空间的守恒关系。
能量守恒_能量守恒 -发展
历史背景
19世纪中叶发现的能量守恒定律是自然科学中十分重要的定律。它的发现是人类对自然科学规律认识逐步积累到一定程度的必然事件。尽管如此,它的发现仍然是曲折艰苦的和激动人心的。能量守恒定律是联系机械能和热能的定律。不言而喻,在它发现之前人们必须对机械能和热能有较深入的研究。
焦耳
和迈尔同时期研究能量守恒的还有一个英国人――焦耳(1818~1889),他自幼在道尔顿门下学习化学、数学、物理,他一边经营父亲留下的啤酒厂,一边搞科学研究。1840年,他发现将通电的金属丝放入水中,水会发热,通过精密的测试,他发现:通电导体所产生的热量与电流强度的平方,导体的电阻和通电时间成正比。这就是焦耳定律。1841年10月,他的论文在《哲学杂志》上刊出。随后,他又发现无论化学能,电能所产生的热都相当于一定功,即460千克米/千卡。1845年,他带上自己的实验仪器及报告,参加在剑桥举行的学术会议。他当场做完实验,并宣布:自然界的力(能)是不能毁灭的,哪里消耗了机械力(能),总得到相当的热。可台下那些赫赫有名的大科学家对这种新理论都摇头,连法拉第也说:“这不太可能吧。”更有一个叫威廉・汤姆孙(1824~1907)的数学教授,他8岁随父亲去大学听课,10岁正式考入该大学,乃是一位奇才,而今天听到一个啤酒匠在这里乱嚷一些奇怪的理论,就非常不礼貌地当场退出会场。焦耳不把人们的不理解放在心上,他回家继续做着实验,这样一直做了40年,他把热功当量精确到了423.9千克米/千卡。
1847年,他带着自己新设计的实验又来到英国科学协会的会议现场。在他极力恳求下,会议主席才给他很少的时间让他只做实验,不做报告。焦耳一边当众演示他的新实验,一边解释:“你们看,机械能是可以定量地转化为热的,反之一千卡的热也可以转化为423.9千克米的功……”突然,台下有人大叫道:“胡说,热是一种物质,是热素,他与功毫无关系”这人正是汤姆孙。焦耳冷静地回答到:“热不能做功,那蒸汽机的活塞为什么会动?能量要是不守恒,永动机为什么总也造不成?”焦耳平淡的几句话顿时使全场鸦雀无声。台下的教授们不由得认真思考起来,有的对焦耳的仪器左看右看,有的就开始争论起来。汤姆孙碰了钉子后,也开始思考,他自己开始做试验,找资料,没想到竟发现了迈尔几年前发表的那篇文章,其思想与焦耳的完全一致!他带上自己的试验成果和迈尔的论文去找焦耳,他抱定负荆请罪的决心,要请焦耳共同探讨这个发现。在啤酒厂里汤姆孙见到了焦耳,看着焦耳的试验室里各种自制的仪器,他深深为焦耳的坚韧不拔而感动。汤姆孙拿出迈尔的论文,说道:“焦耳先生,看来您是对的,我今天是专程来认错的。您看,我是看了这篇论文后,才感到您是对的。”焦耳看到论文,脸上顿时喜色全失:“汤姆孙教授,可惜您再也不能和他讨论问题了。这样一个天才因为不被人理解,已经跳楼自杀了,虽然没摔死,但已经神经错乱了。”汤姆孙低下头,半天无语。一会儿,他抬起头,说道:“真的对不起,我这才知道我的罪过。过去,我们这些人给了您多大的压力呀。请您原谅,一个科学家在新观点面前有时也会表现得很无知的。”一切都变得光明了,两人并肩而坐,开始研究起实验来。1853年,两人终于共同完成能量守恒和转化定律的精确表述。
活力与死力的论战
1644年笛卡尔(ReneDescartes,1596-1650)在他所著的《哲学原理》中讨论碰撞问题时引进了动量的概念,用以度量运动。1687年牛顿(IsacNewton,1642-1727)在他的《自然哲学的数学原理》中把动量的改变来度量力。与此不同的是莱布尼兹(GottfriedWilhelmLeibniz,1646-1716)在1686年的一篇论文中抨击笛卡尔,主张用质量乘速度的平方来度量运动,莱布尼兹称之为活力。把牛顿由动量所度量的力也称为死力。莱布尼兹的主张正好和1669年惠更斯关于碰撞问题研究的结论一致,该结论说“两个物体相互碰撞时,它们的质量与速度平方乘积之和在碰撞前后保持不变。”从莱布尼兹挑起争论起,形成了以笛卡尔和莱布尼兹两大派的论争。这场论战延续了近半个世纪,许多学者都参加了论战,并且各有实验佐证。一直到1743年法国学者达朗贝尔(JeanleRondd'Alembert,1717-1783)在他的《论动力学》中说:“对于量度一个力来说,用它给予一个受它作用而通过一定距离的物体的活力,或者用它给予受它作用一定时间的物体的动量同样都是合理的。”在这里,达朗贝尔揭示了活力是按作用距离力的量度,而动量是按作用时间力的量度。这场争论终于尘埃落定了。活力才作为一个正式的力学名词为力学家们普遍接受。活力虽然为力学家接受了,但是它与力的关系并没有弄清楚。一直到1807年英国学者托马斯・杨(ThomasYoung,1773,5,10-1829,5,10)引进了能量的概念,1831年法国学者科里奥利(GustaveGaspardCoriolis,1792-1843)又引进了力做功的概念,并且在活力前加了1/2系数称为动能,通过积分给出了功与动能的联系,即F=1/2mv2这个式子表示力做功转化为物体的动能。也就是说自然界的机械能是守恒的。
温度计的发明
关于热的精确理论应当从制造温度计开始。从17世纪开始,在意大利有伽利略(GalileiGalileo,1564-1642)等人开始制做温度计。但是由于采用的温标比较不方便,所以后人使用的很少。比较早的实用温标是德国物理学家华伦海(DanielGabrielFahrenheit,1686-1736)从1714年开始使用水银做温度计,并且不断改进,直到1714年确定了现在所称的华氏温标。直到华伦海去世后,科学家才正式确定华氏温标:以水的沸点为212度,把32度定为水的冰点。所以这样规定,是要尽量使通常的温度避免取负值。摄耳修斯像瑞典天文学家摄耳修斯(AndersCelsius,1701-1744)于1742年到1743年发明了摄氏温标,以标准状态下水的结冰温度为零度水的沸点为100度。摄氏温标在1948年被国际度量衡会议定为国际标准。温度计的发明给热学的精确化准备了必要的条件,人们可以用它来测量各种不同条件下物质的温度变化。最早人们并没有把温度和热量区分开来,认为温度就是热量。
潜热的发现
18世纪50年代,英国科学家布莱克(Joseph.Black,1728―1799)把32°F的冰块与相等重量的172°F的水相混合,结果发现,平均温度不是102°F,而是32°F,其效果只是冰块全部融化为水。布莱克由此作出结论:冰在熔解时,需要吸收大量的热量,这些热量使冰变成水,但并不能引起温度的升高。他还猜想到,冰熔解时吸收的热量是一定的。为了弄清楚这个问题,他把实验反过来作,即观测水在凝固时是否也会放出一定的热量。他把摄氏零下4°的过冷却的水不停地振荡,使一部分过冷却水凝固为冰,结果温度上升了;当过冷却水完全凝固时,温度上升到摄氏零度,表明水在凝固时确实放出了热量。进一步的大量实验使布莱克发现,各种物质在发生物态变化(熔解、凝固、汽化、凝结)时,都有这种效应。他曾经用玻璃罩将盛有酒精的器皿罩住,把玻璃罩内的空气抽走,器皿中的酒精就迅速蒸发,结果在玻璃罩外壁上凝结了许多小水珠。这说明液体(酒精)蒸发时要吸收大量的热,因而使玻璃罩冷却了,外壁上才凝结了水珠。布莱克用一个很简单直观的办法来测定水汽化时所需要的热量。他用一个稳定的火来烧一千克零摄氏度的水,使水沸腾,然后继续烧火,直至水完全蒸发掉。他测出使沸腾的水完全蒸发所烧的时间,为使水由0℃升温到沸腾所烧的时间的4.5倍,表明所供热量之比为100∶450。这个实验当然是很粗糙的,所测的数值也有很大的误差;现在的测定表明这个比值为100∶539。布莱克还用类似的方法测出,熔解一定量的冰所需要的热量,和把相同重量的水加热140°F所需要的热量相等(相当于加热77.8℃所需要的热量),这个数值也偏小了一点,正确的数值为143°F(相当于80℃),但在当时,这种测量结果也是很难得的。布莱克基于这些实验事实于1760年开始认识到热量与温度是两个不同的概念,进而在1761年他引入了“潜热”概念。其后,法国科学家拉瓦锡(Antoine-LaurentdeLavoisier,1743-1794)与拉普拉斯(PierreSimomLaplace,1749-1827)合作在1780年提出了正确测量物质热容量的方法。由于热的精确度量的成熟,1822年法国学者傅里叶(JeanBaptisteJosephFourier,1768~1830)出版了他多年关于热学研究的总结著作《热的解析理论》。
热力机械的发明
从远古开始人类就认识到由机械运动可以产生热。无论东方和西方,古代都有钻木取火纪录,这就是把机械运动转变为热的早期实践。不过几千年中一直没有人想到机械能和热能的定量转换问题。直到美国人朗福德(Rumford,BenjaminThompson,Count,1753-1814)1798年在慕尼黑注意到,当用镗具钻削制造炮筒的青铜坯料时,金属坯料象火一样发烫,必须不断用水来冷却。朗福德注意到,只要镗钻不停止,金属就不停地发热;如果把这些热都传给原金属,则足可以把它熔化。朗福德的结论是,镗具的机械运动转化为热,因此热则是一种运动形式,而不是以前人们认为的是一种物质。朗福德还试图计算一定量的机械能所产生的热量。这样朗福德首次给出一个被我们现在称为热功当量的数值。不过他的数值太高。半个世纪以后,焦耳提供了正确值。提到热能转变为机械能,最早应当提到的是亚力山大的希罗(HeroofAlexandria,约公元62年前后)发明的蒸汽机。这项发明是一个空心球体上面连上两段弯管,当球内的水沸腾时,蒸汽通过管子喷出,这个球就迅速旋转,这是最早的蒸汽机。不过那时只是用于祭神与玩耍而没有实际应用。1712年,英国人托马斯・纽可曼(ThomasNewcomen,1663-1729)发明了大气压蒸汽机。这种机器具有汽缸与活塞,在工作时,先把蒸汽导入汽缸,这时汽缸停止供汽而汽缸内进水,蒸汽便遇冷凝结为水使汽缸内气压迅速降低,就可以使水吸上来。之后再把蒸汽导入汽缸,进行下一个循环。最初的这种蒸汽机大约每分钟往返十次,而且可以自动工作,使矿井的抽水工作大为便利,所以不仅英国人使用,在德国与法国也在使用。瓦特(JamesWatt,1736-1819)在18世纪后半叶对蒸汽机进行了改进。其中最重要的改进有两项,一项是发明了冷凝器大大提高了蒸汽机的效率,另一项是发明了离心调速器使蒸汽机速度可自由控制。在瓦特的改进之后蒸汽机才真正在工业上被普遍使用。
永动机的不可能
永动机据说永动机的概念发端于印度,在公元12世纪传入欧洲。据记载欧洲最早、最著名的一个永动机设计方案是十三世纪时一个叫亨内考(VillanddeHonnecourt)的法国人提出来的。
如图所示:轮子中央有一个转动轴,轮子边缘安装着12个可活动的短杆,每个短杆的一端装有一个铁球。随后,研究和发明永动机的人不断涌现。尽管有不少学者研究指出永动机是不可能的,研究永动机的人还是前赴后继。文艺复兴时期意大利伟大学者达芬奇(Leonardodavinc,1452-1519)曾经用不少精力研究永动机。可贵的是他最后得到了永动机不可能的结论。与达芬奇同时代还有一位名叫卡丹的意大利人(JeromeCardan,1501-1576),他以最早给出求解三次方程的根而出名,也认为永动机是不可能的。关于永动机的不可能,还应当提到荷兰物理学家司提芬(SimonStevin,15481620)。16世纪之前,在静力学中,人们只会处理求平行力系的合力和它们的平衡问题,以及把一个力分解为平行力系的问题,还不会处理汇交力系的平衡问题。为了解决这类问题,人们把他归结于解决三个汇交力的平衡问题。通过巧妙的论证解决了这个问题。假如你把一根均匀的链条ABC放置在一个非对称的直立(无摩檫)的楔形体上,如图所示。这时链条上受两个接触面上的反力和自身的重力。恰好是三个汇交力。链条会不会向这边或那边滑动?如果会,往哪一边?司提芬想象把楔形体停在空中,在底部由CDA把链条连起来使之闭合,如图,最后解决了这个问题。在底部悬挂的链条自己是平衡的,把悬挂的部分和上部的链条连起来,斯提芬说:“假如你认为楔形体上的链条不平衡,我就可以造出永动机。”事实上如果链条会滑动,那么你就必然会推出封闭的链条会永远滑下去;这显然是荒谬的,回答必然是链条不动。并且他由此得到了汇交三力平衡的条件。他觉得这一证明很妙,就把图2放在他的著作《数学备忘录(HypomnemataMathematica)》的扉页上,他的同辈又把它刻在他的墓碑上以表达敬仰之意。汇交力系的平衡问题解决,也标志着静力学的成熟。随着对永动机不可能的认识,一些国家对永动机给出了限制。如早在1775年法国科学院就决定不再刊载有关永动机的通讯。1917年美国专利局决定不再受理永动机专利的申请。据英国专利局的助理评审员F.Charlesworth称:英国的第一个永动机专利是1635年,在1617年到1903年之间英国专利局就收到约600项永动机的专利申请。这还不包含利用重力原理之外的永动机专利申请。而美国在1917年之后还是有不少一时看不出奥妙的永动机方案被专利局接受。
迈尔的发现与遭遇迈尔(JuliusRobertMayer,1814-1878)是德国的物理学家。大学时学医,但他并不喜欢当医生,他当过随船医生,工作比较清闲。迈尔在西方大约从公元4世纪开始有一种大量放血的治疗方法。一次大约要放掉12到13盎司(约合340-370克,有一杯之多)的血,有的则一直放血放到病人感觉头晕为止。这种疗法的根据是,在古代的西方有一种所谓“液体病理”的理论,说人体含有多种液体,如血、痰、胆汁等。这些液体的过多或不足都会致病。放血的作用就是排除多余液体一种措施。中世纪西方的有钱人,特别是那些贵族上层人物、绅士们,还要在一年中定期放血,一般要在春秋各放血一次。放血另一种作用是使女人看上去更好看,这和西方当时的审美观有关,使她们既显得白皙,又不会因为害羞而满脸通红。所以西方的贵妇人也经常放血。迈尔作为一名医生,不用说也是经常使用放血疗法给人治病的。大约是在1840年去爪哇的航行中,由于考虑动物体温问题而对物理学发生了兴趣。在泗水,当他为一些患病的水手放血时,他发现静脉的血比较鲜亮,起初他还误以为是切错了动脉。于是他思考,血液比较红是在热带身体不像在温带那样需要更多的氧来燃烧以保持体温。这一现象促使迈尔思考身体内食物转化为热量以及身体能够做功这个事实。从而得出结论,热和功是能够相互转化的。他又注意到当时许多人进行永动机的实验都以失败而告终,从童年时期就给他留下了深刻的影响。这些使他猜想“机械功根本不可能产生于无”。迈尔在1841年9月12日他给友人的信中最早提及了热功当量。他说:“对于我的能用数学的可靠性来阐述的理论来说,极为重要的仍然是解决以下这个问题:某一重物(例如100磅)必须举到地面上多高的地方,才能使得与这一高度相应的运动量和将该重物放下来所获得的运动量正好等于将一磅0℃的冰转化为0℃的水所必要的热量。”1840年2月22日,他作为一名随船医生跟着一支船队来到印度。一日,船队在加尔各达登陆,船员因水土不服都生起病来,于是迈尔依老办法给船员们放血治疗。在德国,医治这种病时只需在病人静脉血管上扎一针,就会放出一股黑红的血来,可是在这里,从静脉里流出的仍然是鲜红的血。于是,迈尔开始思考:人的血液所以是红的是因为里面含有氧,氧在人体内燃烧产生热量,维持人的体温。这里天气炎热,人要维持体温不需要燃烧那么多氧了,所以静脉里的血仍然是鲜红的。那么,人身上的热量到底是从哪来的?顶多500克的心脏,它的运动根本无法产生如此多的热,无法光靠它维持人的体温。那体温是靠全身血肉维持的了,而这又靠人吃的食物而来,不论吃肉吃菜,都一定是由植物而来,植物是靠太阳的光热而生长的。太阳的光热呢?太阳如果是一块煤,那么它能烧4600年,这当然不可能,那一定是别的原因了,是我们未知的能量了。他大胆地推出,太阳中心约2000万度(现在我们知道是1500万度)。迈尔越想越多,最后归结到一点:能量如何转化(转移)?他一回到汉堡就写了一篇《论无机界的力》,并用自己的方法测得热功当量为365千克米/千卡。他将论文投到《物理年鉴》,却得不到发表,只好发表在一本名不见经传的医学杂志上。他到处演说:“你们看,太阳挥洒着光与热,地球上的植物吸收了它们,并生出化学物质……”可是即使物理学家们也无法相信他的话,很不尊敬地称他为“疯子”,而迈尔的家人也怀疑他疯了,竟要请医生来医治他。他不仅在学术上不被人理解,而且又先后经历了生活上的打击,幼子逝世,弟弟也因革命活动受到牵连,在一连串的打击迈尔于1849年从三层楼上跳下自杀,但是未遂,却造成双腿伤残,从而成了跛子。随后他被送到哥根廷精神病院,遭受了八年的非人折磨。1858年,世界又重新发现了迈尔,他从精神病院出来以后,被瑞士巴塞尔自然科学院授为荣誉博士。晚年的迈尔也可以说是苦尽甘来,在晚年他先后获得了英国皇家学会的科普利奖章,还获得了蒂宾根大学的荣誉哲学博士、巴伐利亚和意大利都令科学院院士的称号。1878年3月20日迈尔在海尔布逝世。1842年3月,迈尔写了一篇短文《关于无机界的力的看法》寄给了《药剂学和化学编年史》的主编、德国化学家李比希(JustusvonLiebig,1803-1873),李比希立即答应使用这篇文章。机械的热功当量在这篇文章中得到第一次说明。文中说:“人们发现,一重物从大约365米高处下落所做的功,相当于把同重量的水从0℃升到1℃所需的热量。”他的文章发表于1842年5月。迈尔是最早进行热功当量实验的学者,在1842年,他用一匹马拉机械装置去搅拌锅中的纸浆,比较了马所做的功与纸浆的温升,给出了热功当量的数值。他的实验比起后来焦耳的实验来,显得粗糙,但是他深深认识到这个问题的重大意义,并且最早表述了能量守恒定律。他在1842年底给友人的信中说:“我主观认为,表明我的定律的绝对真理性的是这种相反的证明:即一个在科学上得到普遍公认的定理:永动机的设计在理论上是绝对不可能的(这就是说,即使人们不考虑力学上的困难,比方说摩擦等等,人们也不可能成功地由思想上设计出来)。而我的断言可以全部被视为从这种不能原则中得出的纯结论。要是有人否认我的这个定理,那么我就能立即建造一部永动机。”迈尔的论文没有引起社会重视,为了补足第一篇论文没有计算、过于简要的缺点,他写了第二篇论文,结果如石沉大海,没有被采用。他论证了太阳是地球上所有有生命能与非生命能的最终源泉。后来亥姆霍兹与焦耳的论文相继发表,人们将能量守恒定理的发明人归于亥姆霍兹与焦耳。而他的论文既早又系统,却不仅得不到承认,而且还招来了一些攻击文章。再加1848年,他祸不单行,两个孩子夭折、弟弟又因参加革命活动受牵连。1849年,迈尔从三楼跳下,从此成为重残,而后又被诊断为精神分裂,送入精神病院,医生们认为他经常谈论的那种新发现,是一种自大狂的精神病症状。1858年亥姆霍兹阅读了迈尔1852年的论文,并且承认迈尔早于自己影响很广的论文。克劳修斯也认为迈尔是守恒定律的发现者。克劳修斯把这一事实告诉了英国声学家丁铎尔(JohnTyndall,1820-1893),一直到1862年由于丁铎尔在伦敦皇家学会上系统介绍了他的工作,他的成就才得到社会公认。1860年迈尔的早期论文翻译成英文出版,1870年之迈尔被选为巴黎科学院的通讯成员,并且获得了彭赛列奖(PrixPoncelet)。之后迈尔的命运有很大的改善。
亥姆霍兹
亥姆霍兹(HermannvonHelmholtz,1821-1894)出生在一个德国的穷教员家里,中学毕业后在军队服役8年,取得公费进入在柏林的王家医学科学院。1842年亥姆霍兹获得了博士学位。1845年他参加了由年轻的学者组织的柏林物理学协会,之后他经常参加协会活动,除作军医之外他还研究一切他感兴趣的问题。1847年7月23日他向物理学协会作了题为《论力的守恒》的著名报告。报告后,他将文章交给《物理学编年史》的编辑,不料又经历了和6年前迈尔的稿件一样的命运,编辑以没有实验事实为由拒绝刊登。后来他将这篇论文作为小册子在另一家有名的出版社出版了。文章的结论与1843年焦耳的实验完全一致,很快就被人们称为“自然界最高又最重要的原理”。时间仅差数年,又由于有有名的出版社出版,他与迈尔的命运完全不同。后来英国学者开尔文采用了杨所提出的能量的概念,采用“势能”代替“弹力”,以“动能”代替“活力”,使在力学中延续了近200年的概念上含混不清的情况得到改变。关于亥姆霍兹值得介绍的是他在德国科学家发展中所起的组织作用。
1870年,他的老师马格努斯(HeinrichGustavMagnus,1802-1870),德国最早的物理研究所所长,逝世了。当时还是副教授的亥姆霍兹继任为所长。那时,德国的科学研究水平,比起英国与法国要落后得多。不久普法战争结束,德国从法国得到一大笔赔款,德国的经济状况有所改善,亥姆霍兹得到了300万马克的经费去筹建新的研究所,经过5年的努力新研究所建成。这个研究所后来吸引了大批优秀的年轻学者,而且它的研究课题同工业的发展紧密联系,后来形成德国科学研究的一个十分好的传统。在研究所的支持者中有德国的大企业家、大发明家西门子(SirWilliamSiemens,1823-1883)他与亥姆霍兹是柏林物理协会的第一批会员,是老朋友。亥姆霍兹担任德国物理协会会长达数十年之久。被人称为“德国物理的宰相”。焦耳的热功当量实验焦耳(JamesPrescottJoule,1818-1889)是一位英国富有的酿造商之子,他的经济条件可以提供他终生做研究工作。焦耳自幼身体虚弱,脊柱曾受过伤,因此他一心读书研究,他父亲为他提供了一个家庭实验室。1835年他认识了曼彻斯特大学的教授道尔顿,受到过后者的指导,焦耳的成功主要是靠自学的。焦耳对数学的知识很少,他的研究主要是靠测量。
1840年他经过多次测量通电的导体,发现电能可以转化为热能,并且得出一条定律:电导体所产生的热量与电流强度的平方、导体的电阻和通过的时间成正比。他将这一定律写成一篇论文《论伏打电生热》。后来焦耳继续探讨各种运动形式之间的能量守恒与转化关系,1843年他发表了论文《论水电解时产生的热》与《论电磁的热效应和热的机械值》。特别在后一篇论文中,焦耳在英国学术会议上宣称:“自然界的能是不能毁灭的,那里消耗了机械能,总能得到相当的热,热只是能的一种形式。”此后焦耳不断改进测量方法,提高测量精度,最后得到了一个被称为“热功当量”的物理常数,焦耳当时测得的值是423.9千克米/千卡。现在这个常数的值是418.4。后人为纪念他,在国际单位制中采用焦耳为热量的单位,取1卡=4.184焦耳。
历史小结
只有在功与能的概念变得清晰、热量于温度能够区分,同时对它们能够精确量度,也只有热力机械的走向实用为人们所熟悉,并且在大量永动机的失败条件下,能量守恒定律发现的条件才趋于成熟。即使这样,人们对先知先觉者的理解也是相对缓慢的。迈尔的遭遇就说明这一点。
发展前沿
关于能量守恒定律的最新研究,目前有研究者认为,能量守恒定律需要条件限制,它并不是在任何情况任何时空都是普适的,认为时间平移不变性是能量守恒的条件。还有研究者通过分析能量守恒定律,认为各种形式能量的转换遵循等量转换原则是能量守恒定律成立的基本条件,指出了长期以来物理学界一直把∑E=常量等同于能量守恒是对能量守恒定律认识不足.换位思考能量守恒定律对坐标变换的要求,得出能量守恒定律对坐标变换的要求。关于人们对于能量守恒定律的认识和研究还需要更进一步的深入。
 爱华网
爱华网