非金属在通常条件下为气体或没有金属特性的脆性固体或液体,如元素周期表右上部15个元素和氢元素,零族元素的单质。大部分非金属原子具有较多的价层s、p电子,可以形成双原子分子气体或骨架状,链状或层状大分子的晶体结构。当温度或压力等条件发生变化时,金属或非金属可能转化。如金属锡在低温下可变成非金属的灰锡。
非金属_非金属 -简介
元素的金属性是指元素的原子失电子的能力;元素的非金属性是指元素的原子得电子的能力。
元素的金属性与非金属性是一个看似简单,却有着许多内容值得深思的知识点。金属性与非金属性讨论的对象是元素,它是一个广义的概念,而元素的金属性与非金属性具体表现为该元素单质或特定化合物的性质,
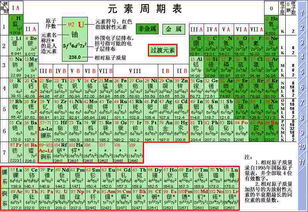
通常条件下为气体或没有金属特性的脆性固体或液体,如元素周期表右上部15种元素和氢元素,零族元素的单质。非金属元素是元素的一大类,在所有的一百多种化学元素中,非金属占了22种。在周期表中,除氢以外,其它非金属元素都排在表的右侧和上侧,属于p区。包括氢、硼、碳、氮、氧、氟、硅、磷、硫、氯、砷、硒、溴、碲、碘、砹、氦、氖、氩、氪、氙、氡。80%的非金属元素在现在社会中占有重要位置。
大部分非金属原子具有较多的价层s、p电子,可以形成双原子分子气体或骨架状,链状或层状大分子的晶体结构。
金属和非金属之间有被称为类金属的砷,锑,硅,锗等。
当温度或压力等条件发生变化时,金属或非金属可能转化。如金属锡在低温下可变成非金属的灰锡。
非金属_非金属 -非金属性与元素在周期表中的位置关系
对于主族元素来说,同周期元素随着原子序数的递增,原子核电荷数逐渐增大,而电子层数却没有变化,因此原子核对核外电子的引力逐渐增强,随原子半径逐渐减小,原子失电子能力逐渐降低,元素金属性逐渐减弱;而原子得电子能力逐渐增强,元素非金属性逐渐增强。例如:对于第三周期元素的金属性Na>Mg<Al,非金属性Cl>S>P>Si。
同主族元素,随着原子序数的递增,电子层逐渐增大,原子半径明显增大,原子核对最外层电子的引力逐渐减小,元素的原子失电子逐渐增强,得电子能力逐渐减弱,所以元素的金属性逐渐增强,非金属性减弱。例如:第一主族元素的金属性H<Li<Na<K<Rb<Cs,卤族元素的非金属性F>Cl>Br>I。
综合以上两种情况,可以作出简明的结论:在元素周期表中,越向左、下方,元素金属性越强,金属性最强的金属是Cs;越向右、上方,元素的非金属越强,非金属性最强的元素是F。例如:金属性K>Na>Mg,非金属性O>S>P。
非金属_非金属 -化学反应
一般说来,元素的金属性越强,它的单质与水或酸反应越剧烈,对于的碱的碱性也越强。例如:金属性Na>Mg>Al,常温时单质Na与水能剧烈反应,单质Mg与水能缓慢地进行反应,而单质Al与水在常温时很难进行反应,它们对应的氧化物的水化物的碱性 NaOH>Mg(OH)2>Al(OH)3。元素的非金属性越强,它的单质与H2反应越剧烈,得到的气态氢化物的稳定性越强,元素的最高价氧化物所对应的水化物的酸也越强。例如:非金属Cl>S>P>Si,Cl2与H2在光照或点燃时就可能发生爆炸而化合,S与H2须加热才能化合,而Si与H2须在高温下才能化合并且SiH4极不稳定;氢化物的稳定HCl>H2S>PH3>SiH4;这些元素的最高价氧化物的水化物的酸性HClO4>H2SO4>H3PO4>H4SiO4。因此,在化学反应中的表现可以作为判断元素的金属性或非金属强弱的依据。另外,还可以根据金属或非金属单质之间的相互置换反应,进行金属性和非金属性强弱的判断。一种金属把另一金属元素从它的盐溶液里置换出来,表明前一种元素金属性较强;一种非金属单质能把另一种非金属单质从它的盐溶液或酸溶液中置换出来,表明前一种元素的非金属性较强。
非金属_非金属 -氧化还原性的关系
元素的金属性越强,它的单质还原性越强,而它阳离子的氧化性越弱。例如:金属性Na>Mg>Al,单质的还原性Na>Mg>Al,阳离子的氧化性Na<Mg<Al。中学化学教材中金属活动顺序表为K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>H>Cu>Hg>Ag>Pt>Au,而阳离子的氧化性为K<Ca<Na<Mg<Al<Zn<Fe<Sn<Pb<H<Cu<Hg<Pt<Au。元素的非金属性越强,它的单质的氧化性越强,还原性越弱,而它阴离子的还原性越越弱。例如:非金属性Cl>Br>I>S,它们的单质的氧化性Cl2>Br2>I2>S,还原性Cl2<Br2<I2<S,它们的阴离子的还原性Cl<Br<I<S。
非金属_非金属 -与金属单质的熔、沸点等的关系
在金属晶体中,金属原子的自由电子在整个晶体中移动,依靠此种流动电子,使金属原子相互结合成为晶体的键称为金属键。对于主族元素,随原子序数的递增,金属键的强度逐渐减弱,因此金属单的熔、沸点逐渐降低。
非金属_非金属 -化合物
由于非金属元素复杂的成键方式,几乎所有的化合物中都含有非金属元素。
如果非金属元素与金属元素一同形成无机化合物,则可以形成无氧酸盐、含氧酸盐及配合物这几类物质。如果只由非金属元素形成无机物,则可以形成一系列共价化合物,如酸等。
非金属元素碳是有机化合物的基础。
分子氢化物
除稀有气体以外,所有非金属元素都能形成最高价态的共价型简单氢化物。熔沸点:同一族的熔点、沸点从上到下递增。但NH3、H2O、HF的沸点因为存在氢键而特别高。热稳定性:同一周期自左向右依次增加,同一族自上而下减少,与非金属元素电负性变化规律一样。还原性:除HF外都具有还原性,其变化规律与稳定性相反,稳定性大的还原性小。此外C、Si、B能分别形成碳烷、硅烷、硼烷一系列非金属原子数≥2的氢化物。
含氧酸及其盐
除稀有气体、氧、氟元素以外,所有非金属元素都能形成含氧酸,且在酸中呈正氧化态。同一族从下到上、同一周期从左到右,非金属最高价含氧酸的酸性逐渐增强。但其他价含氧酸不遵循此规律。非金属含氧酸中,高氧化态的强酸常具有氧化性,如硫酸(H2SO4)、硝酸(HNO3)等;一些弱酸如次氯酸也是氧化性酸。还原性酸包括亚硫酸、亚磷酸等。
非金属_非金属 -造字法

在中文中,非金属元素的名称都没有金字旁,而是以它们在常温下的状态分别加气字头、三点水、石字旁。
非金属_非金属 -非金属单质
氧化性
F2+H2===2HF
F2+Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2+2M===2MFn(表示大部分金属)
2F2+2H2O===4HF+O2
2F2+2NaOH===2NaF+OF2+H2O
F2+2NaCl===2NaF+Cl2
F2+2NaBr===2NaF+Br2
F2+2NaI===2NaF+I2
F2+Cl2(等体积)===2ClF
3F2(过量)+Cl2===2ClF3
7F2(过量)+I2===2IF7
Cl2+H2===2HCl
3Cl2+2P===2PCl3
Cl2+PCl3===PCl5
Cl2+2Na===2NaCl
3Cl2+2Fe===2FeCl3
Cl2+2FeCl2===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2+2NaI===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2+Na2S===2NaCl+S
Cl2+H2S===2HCl+S
Cl2+SO2+2H2O===H2SO4+2HCl
Cl2+H2O2===2HCl+O2
2O2+3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
N2+3H2===2NH3
N2+3Mg===Mg3N2
N2+3Ca===Ca3N2
N2+3Ba===Ba3N2
N2+6Na===2Na3N
N2+6K===2K3N
N2+6Rb===2Rb3N
P2+6H2===4PH3
P+3Na===Na3P
2P+3Zn===Zn3P2
还原性
S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4HNO3(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5)
2P+3X2===2PX3(X表示F2,Cl2,Br2)
PX3+X2===PX5
P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4
C+2Cl2===CCl4
2C+O2(少量)===2CO
C+O2(足量)===CO2
C+CO2===2CO
C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl2===SiCl4
(SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2===SiO2
Si+C===SiC(金刚砂)
Si+2NaOH+H2O===Na2SiO3+2H2
非金属_非金属 -非金属及其化合物知识点
一、二氧化硫
制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
S+O2===(点燃)SO2
物理性质:无色、刺激性气味、容易液化,易溶于水(1:40体积比)
化学性质:有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色。这是因为H2SO3不稳定,会分解回水和SO2
SO2+H2OH2SO3因此这个化合和分解的过程可以同时进行,为可逆反应。
可逆反应--在同一条件下,既可以往正反应方向发生,又可以向逆反应方向发生的化学反应称作可逆反应,用可逆箭头符号连接。
二、一氧化氮和二氧化氮
一氧化氮在自然界形成条件为高温或放电:N2+O2========(高温或放电)2NO,生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮:2NO+O2==2NO2
一氧化氮的介绍:无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。
二氧化氮的介绍:红棕色气体、刺激性气味、有毒、易液化、易溶于水,并与水反应:
3NO2+H2O==2HNO3+NO这是工业制硝酸的方法。
三、大气污染
SO2、NO2溶于雨水形成酸雨。防治措施:
①从燃料燃烧入手。
②从立法管理入手。
③从能源利用和开发入手。
④从废气回收利用,化害为利入手。
(2SO2+O22SO3SO3+H2O=H2SO4)
四、硫酸
物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大。
化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性。是强氧化剂。
C12H22O11======(浓H2SO4)12C+11H2O放热
2H2SO4(浓)+CCO2↑+2H2O+SO2↑
还能氧化排在氢后面的金属,但不放出氢气。
2H2SO4(浓)+CuCuSO4+2H2O+SO2↑
稀硫酸:与活泼金属反应放出H2,使酸碱指示剂紫色石蕊变红,与某些盐反应,与碱性氧化物反应,与碱中和
五、硝酸
物理性质:无色液体,易挥发,沸点较低,密度比水大。
化学性质:具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。还能氧化排在氢后面的金属,但不放出氢气
4HNO3(浓)+Cu==Cu(NO3)2+2NO2↑+4H2O
8HNO3(稀)+3Cu3Cu(NO3)2+2NO↑+4H2O
反应条件不同,硝酸被还原得到的产物不同,可以有以下产物:N(+4)O2,HN(+3)O2,N(+2)O,N(+1)2O,N(0)2,N(-3)H3△硫酸和硝酸:浓硫酸和浓硝酸都能钝化某些金属(如铁和铝)使表面生成一层致密的氧化保护膜,隔绝内层金属与酸,阻止反应进一步发生。因此,铁铝容器可以盛装冷的浓硫酸和浓硝酸。硝酸和硫酸都是重要的化工原料和实验室必备的重要试剂。可用于制化肥、农药、炸药、染料、盐类等。硫酸还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸。
六、氨气及铵盐
氨气的性质:无色气体,刺激性气味、密度小于空气、极易溶于水(且快)1:700体积比。溶于水发生以下反应使水溶液呈碱性:NH3+H2ONH3?H2ONH4++OH-可作红色喷泉实验。生成的一水合氨NH3?H2O是一种弱碱,很不稳定,会分解,受热更不稳定:NH3?H2O===(△)NH3↑+H2O
浓氨水易挥发除氨气,有刺激难闻的气味。
氨气能跟酸反应生成铵盐:NH3+HCl==NH4Cl(晶体)
氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都离不开它。氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用作制冷剂。
铵盐的性质:易溶于水(很多化肥都是铵盐),受热易分解,放出氨气:
NH4ClNH3↑+HCl↑
NH4HCO3NH3↑+H2O↑+CO2↑
可以用于实验室制取氨气:(干燥铵盐与和碱固体混合加热)
NH4NO3+NaOHNaNO3+H2O+NH3↑
2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑
用向下排空气法收集,红色石蕊试纸检验是否收集满。
 爱华网
爱华网