碳酸钠(Na2CO3),俗名苏打、石碱、纯碱、洗涤碱,碳酸钠为强电解质。具有盐的通性。是重要的化工原料之一,广泛应用于轻工日化、建材、化学工业、食品工业、冶金、纺织、石油、国防、医药等领域。
纯碱_碳酸钠 -简介
碳酸钠又俗称口碱(历史上,一般经张家口和古北口转运全国,因此又有“口碱”之说。),无结晶水的工业名称为轻质碱,有一个结晶水的工业名称为重质碱。存在于自然界(如盐水湖)的碳酸钠称为天然碱。
无结晶水的碳酸钠的工业名称为轻质碱,有一个结晶水碳酸钠的工业名称为重质碱。
碳酸钠属于盐,不属于碱。因为碳酸钠的水溶液呈碱性,因此又名纯碱等说法。
纯碱_碳酸钠 -物理性质
口味发涩。标准摩尔生成热ΔfHmθ(kJ・mol^-1):-1130.7,标准摩尔生成吉布斯自由能ΔfGmθ(kJ・mol^-1):-1044.4,标准熵Smθ(J・mol^-1・K^-1):135.0。
含有结晶水的碳酸钠有3种:Na2CO3・H2O、Na2CO3・7H2O和Na2CO3・1
碳酸钠0H2O。 微溶于无水乙醇,不溶于丙醇。
有吸湿性。露置空气中逐渐吸收1mol/L水分(约15%)。400℃时开始失去二氧化碳。遇酸分解并泡腾。溶于水(室温时3.5份,35℃时2.2份)和甘油,不溶于乙醇。水溶液呈强碱性,pH11.6。半数致死量(30日)(小鼠,腹腔)116.6mg/kg。有刺激性。
纯碱_碳酸钠 -化学性质
在空气中易风化。
(1)其水溶液呈碱性,能与酸产生一定反应。
Na2CO3+ 2HCl ==== 2NaCl + H2O + CO2↑(酸过量)
Na2CO3+ HCl ==== NaCl + NaHCO3(碳酸钠过量)
(2) Na2CO3与碱反应。
Na2CO3+ Ca(OH)2==== CaCO3↓+ 2NaOH
Na2CO3+ Ba(OH)2==== BaCO3↓+2NaOH
Na2CO3与NaOH不反应。
(3) Na2CO3与盐反应。
Na2CO3+ BaCl2==== 2NaCl + BaCO3↓[碳酸钡为白色沉淀,不溶于水(难溶于水),但可溶于酸]
Na2CO3+MgCl2====2NaCl+MgCO3↓
Na2CO3+MgSO4====Na2SO4+MgCO3↓
Na2CO3+ZnSO4====Na2SO4+ZnCO3↓
3Na2CO3+ Al2(SO4)3+ 3H2O==== 2Al(OH)3↓+ 3Na2SO4+ 3CO2↑[氧化铝白色沉淀,不溶于水,可溶于酸]
(4)Na2CO3+H2O+CO2=2NaHCO3
稳定性较强,但高温下也可分解,生成氧化钠和二氧化碳。长期暴露在空气中能吸收空气中的水分及二氧化碳,生成碳酸氢钠,并结成硬块。吸湿性很强 ,很容易结成硬块,在高温下也不分解。
纯碱_碳酸钠 -制备方法
实验室制取碳酸钠:2NaOH+CO2=Na2CO3+H2O。
技术发展简史:存在于自然界(如盐水湖)的碳酸钠称为天然碱,在古代便被用作洗涤剂和用于印染。1791年开始用食盐、硫酸、煤、石灰石为原料生产碳酸钠,是为吕布兰法,此法由于其自身的诸多弊端逐渐为索尔维法代替。1859年比利时索尔维用食盐、氨水、二氧化碳为原料,于室温下从溶液中析出碳酸氢钠,将它加热,即分解为碳酸钠,此法被沿用至今。用于生产玻璃、造纸、纺织、洗涤剂1943年中国侯德榜结合中国内地缺盐的国情 ,对索尔维法进行改进,将纯碱和合成氨两大工业联合,同时生产碳酸钠和化肥氯化铵,大大地提高了食盐利用率,是为侯氏制碱法。
吕布兰法
最早在1791年,古人就开始用食盐、硫酸、煤、石灰石为原料生产碳酸钠,是为吕布兰法。
此法原料利用不充分、劳动条件恶劣、产品质量不佳,逐渐为索尔维法代替。
索氏制碱法
主要化学反应式均为:NaCl + CO2+ NH3+ H2O ==== NaHCO3↓+ NH4Cl ,NaHCO3(碳酸氢钠)可溶只是在这种条件下,碳酸氢钠溶解的量大约该条件下的溶解度,所以析出了碳酸氢钠固体,经过滤,得到
碳酸钠碳酸氢钠固体。
2NaHCO3==Δ== Na2CO3+ CO2↑+ H2O
所不同的是索氏法在整个制取过程中NH3是循环使用的:
2NH4Cl + Ca(OH)2==Δ== 2NH3↑+ CaCl2+ 2H2O
侯氏制碱法
(1)NH3+ H2O + CO2==== NH4HCO3
(2)NH4HCO3+ NaCl(饱和) ==== NH4Cl+ NaHCO3↓(平时这样的反应一般认为不进行,但是由于在某个温度下,碳酸氢钠的溶解度较低,会沉淀出来,所以这个反应能够一定程度上进行)
(3)2NaHCO3=Δ== Na2CO3+ H2O+ CO2↑ 即:
①NaCl(饱和) + NH3+ H2O + CO2==== NH4Cl + NaHCO3↓
②2NaHCO3=Δ== Na2CO3+ H2O + CO2↑
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步。第二步是:碳酸氢铵与氯化钠反应生成的碳酸氢钠沉淀和氯化铵,碳酸氢钠之所以沉淀是因为它的溶解度较小。
根据 NH4Cl 溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥。
此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %;NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了CaCO3制CO2这一工序。
纯碱_碳酸钠 -主要用途
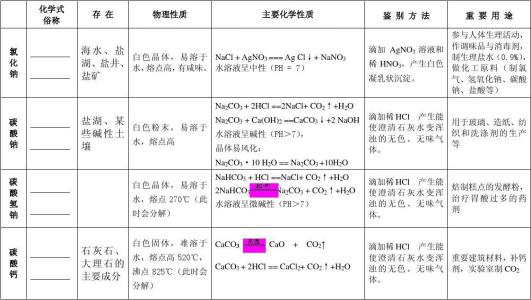
建材领域,玻璃工业是纯碱的最大消费部门,每吨玻璃消耗纯碱0.2吨。
化学工业,用于制水玻璃、重铬酸钠、硝酸钠、氟化钠、小苏打、硼砂、磷酸三钠等。
冶金工业,用作冶炼助熔剂、选矿用浮选剂,炼钢和炼锑用作脱硫剂
印染工业,用作软水剂。
制革工业,用于原料皮的脱脂、中和铬鞣革和提高铬鞣液碱度。
日化方面,用于生产合成洗涤剂添加剂三聚磷酸钠和其他磷酸钠盐等。
食品工业,食用级纯碱用于生产味精、面食等。 用于食品工业,作中和剂、膨松剂,如制造氨基酸、酱油和面制食品如馒头、面包等。还可配成碱水加入面食中,增加弹性和延展性。
此外,在分析化验领域,定量分析中标定酸液的基准。测定铝、硫、铜、铅和锌。检验尿液和全血葡萄糖。分析水泥中二氧化硅的助熔剂、金属金相分析等。
纯碱_碳酸钠 -安全性
危害
健康危害: 本品具有刺激性和腐蚀性。直接接触可引起皮肤和眼灼伤。生产中吸入其粉尘和烟雾可引起呼吸道刺激和结膜炎,还可有鼻粘膜溃疡、萎缩及鼻中隔穿孔。长时间接触本品溶液可发生湿疹、皮炎、鸡眼状溃疡和皮肤松驰。接触本品的作业工人呼吸器官疾病发病率升高。误服可造成消化道灼伤、粘膜糜烂、出血和休克。
燃爆危险: 本品不燃,具腐蚀性、刺激性,可致人体灼伤。
急救措施
皮肤接触: 立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。
眼睛接触: 立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入: 脱离现场至空气新鲜处。如呼吸困难,给输氧。就医。
食入: 用水漱口,给饮牛奶或蛋清。就医。
泄漏应急处理
隔离泄漏污染区,限制出入。建议应急处理人员戴防尘面具(全面罩),穿防毒服。避免扬尘,小心扫起,置于袋中转移至安全场所。若大量泄漏,用塑料布、帆布覆盖。收集回收或运至废物处理场所处置。
纯碱_碳酸钠 -危害
健康危害
该品具有弱刺激性和弱腐蚀性。直接接触可引起皮肤和眼灼伤。生产中吸入其粉尘和烟雾可引起呼吸道刺激和结膜炎,还可有鼻粘膜溃疡、萎缩及鼻中隔穿孔。长时间接触该品溶液可发生湿疹、皮炎、鸡眼状溃疡和皮肤松弛。接触该品的作业工人呼吸器官疾病发病率升高。误服可造成消化道灼伤、粘膜糜烂、出血和休克。
使用须知
穿戴适当的防护服和手套。
不慎与眼睛接触后,请立即用大量清水冲洗并征求医生意见。
切勿吸入粉尘。
穿戴适当的防护服。
戴护目镜或面具。
吞食有害。
刺激眼睛。
对水生生物有毒,可能对水体环境产生长期不良影响。
刺激眼睛、呼吸系统和皮肤。
刺激呼吸系统和皮肤。
对眼睛有严重伤害。
毒理学资料
LD50:4090mg/kg(大鼠经口)
LC50:2300mg/m3,2小时(大鼠吸入)
燃爆危险
该品不燃,具腐蚀性、刺激性.
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。
(在实验里,不小心沾到了碱液的时候,我们要用较多的水去冲洗,然后再涂上硼酸溶液来进行反应)
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入:脱离现场至空气新鲜处。如呼吸困难,给输氧。就医。
食入:用水漱口,给饮牛奶或蛋清。就医。
消防措施
危险特性:具有腐蚀性。未有特殊的燃烧爆炸特性。
有害燃烧产物:自然分解产物未知。
灭火方法:消防人员必须穿全身耐酸碱消防服。灭火时尽可能将容器从火场移至空旷处。
泄漏应急处理
隔离泄漏污染区,限制出入。建议应急处理人员戴防尘面具(全面罩),穿防毒服。避免扬尘,小心扫起,置于袋中转移至安全场所。若大量泄漏,用塑料布、帆布覆盖。收集回收或运至废物处理场所处置。
注意事项
密闭操作,加强通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。避免产生粉尘。避免与酸类接触。搬运时要轻装轻卸,防止包装及容器损坏。配备泄漏应急处理设备。倒空的容器可能残留有害物。稀释或制备溶液时,应把碱加入水中,避免沸腾和飞溅。
储存注意事项
储存于阴凉、通风的库房。远离火种、热源。应与酸类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
【禁配物】强酸、铝、氟
运输注意事项
起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与酸类、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。车辆运输完毕应进行彻底清扫。
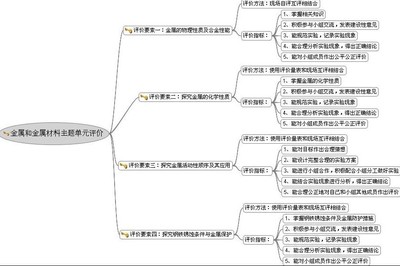
纯碱_碳酸钠 -教育要点
初中阶段
初中一般要求掌握有关碳酸钠的俗称(纯碱、苏打),主要用途,化学式以及一些常用反应
如:
要特别注意碳酸钠虽然俗名纯碱但其实是一种盐。
高中阶段
高中则要求掌握与NaHCO3在性质(溶解性、热稳定性、碱性强弱、与酸的反应速率等)用途等方面的区别以及两者的鉴定方法等。
其中以Na2CO3为代表的强碱弱酸盐的电离和水解的概念理解、电离和水解平衡的计算尤为重要。
纯碱_碳酸钠 -纯碱发展
工业发展
8.1.12006年快速发展
2006年碳酸钠良好市场需求推动中国纯碱工业稳步发展。在产量不能满足市场需求高增长的影响下,促使国内纯碱价格持续走高。2006年,国内纯碱主流平均出厂价格由年初1300元/吨上涨至年末的1500元/吨,上涨幅度15.38%。
2006年是中国纯碱工业发展最好的时期与阶段。纯碱工业良好的发展主要得益于旺盛的国内市场需求、国际贸易环境的改善、国际能源价格的上涨、产品竞争能力的提高和国家对纯碱工业的有序发展的正确规划管理。在国际市场中,中国纯碱产品质量和具有竞争能力的价格,使得中国纯碱在国际市场的贸易份额中不断增加。国际市场需求量的加大,有力地促进了国内纯碱工业的发展。
8.1.22007年高速发展
2007年全年中国纯碱产量1771.8万吨同比增长13.1%。增长率比上年提高2.6个百分点。纯碱出口全年170.6万吨,同比增长-5.7%。表观消费量1605.2万吨,同比增长14.7%。价格由年初的平均1500元/吨上升至年末1800元/吨,上涨幅度20%。
近两年国内化工行业、冶金行业、电子工业、建材行业、装饰行业等快速发展,对纯碱需求十分旺盛,使得中国纯碱产销量呈现连续、稳定的增长,行业开工率保持在90%以上。受下游产业快速增长拉动,预计未来几年中国纯碱将会继续保持较快增长。
发展方向
“十一五”期间,中国纯碱工业发展的重点:
加快产品结构调整、继续增加重质纯碱生产能力和产量、继续增加干铵的能力和产量;进一步提高联碱法纯碱质量;努力降低能耗和物耗,降低成本;严格控制新增能力,推动行业战略性重组;实施国际化经营战略和资源战略。
纯碱是重要的化工原料之一,用于制造化学品、洗涤剂、医药品等。
2011年前三季度,中国纯碱行业受下游行业拉动经济运行平稳。截止到9月底,全国累计生产纯碱1725万吨,比2010年同期增长11.7%。
我国主要大型纯碱企业集中在渤海湾周围,基本都靠近大型盐场,能够满足大型纯碱装置需要的原盐和水资源供应。西北地区青海碱业公司和西南和邦集团纯碱装置投产后,生产重心开始向西转移,地域产业特色已然形成。
[8]我国正处在城市化进程中,对房子的需求非常大,因而平板玻璃行业需求有望保持在15%以上的增长速度,这将继续拉动纯碱的市场需求。
纯碱_碳酸钠 -二氧化碳
实验室制取二氧化碳
碳酸钠与盐酸反应生成氯化钠,水和二氧化碳
纯碱_碳酸钠 -三姐妹
家里的碱面一般是碳酸钠,称为苏打。
在奇妙的化学王国里,住着小有名气的“苏打氏三姐妹”――苏打(Na2CO3)、小苏打(NaHCO3)和大苏打(Na2S2O3・5H2O)。别看它们的名字这样相似,它们的脾气(性质)却不一样,对人类的贡献(用途)也各不相同。
苏打
苏打是Soda的音译,化学式为Na2CO3。它的名字颇多,学名叫碳酸钠,俗名除叫苏打外,又称纯碱或苏打粉。带有结晶水的叫水合碳酸钠,有一水碳酸钠(Na2CO3・H2O)、七水碳酸钠(Na2CO3・7H2O)和十水碳酸钠(Na2CO3・10H2O)三种。十水碳酸钠又叫洗濯苏打、洗濯碱或晶碱。
无水碳酸钠是白色粉末或细粒,易溶于水,水溶液呈碱性。它有很强的吸湿性,在空气中能吸收水分而结成硬块。十水碳酸钠是无色晶体,室温下放置空气中,会失去结晶水而成为一水碳酸钠。无论十水碳酸钠还是一水碳酸钠,加热都会变成无水碳酸钠。碳酸钠很稳定,受热不易分解。遇酸能放出二氧化碳:
碳酸钠溶液还能吸收二氧化碳而成碳酸氢钠:
在三种苏打中,碳酸钠的用途最广。它是一种十分重要的化工产品,是玻璃、肥皂、纺织、造纸、制革等工业的重要原料。冶金工业以及净化水也都用到它。它还可用于其他钠化合物的制造。早在十八世纪,它就和硫酸、盐酸、硝酸、烧碱并列为基础化工原料--三酸两碱之一。在日常生活中,苏打也有很多用途,比如它可以直接作为洗涤剂使用,在蒸馒头时加一些苏打,可以中和发酵过程中产生的酸性物质。
小苏打
小苏打的化学式是NaHCO3。它的名字也有很多,学名碳酸氢钠,又称重碳酸钠或酸式碳酸钠。俗名除小苏打外,还有焙烧苏打、发酵苏打和重碱等。
小苏打是白色晶体,溶于水,水溶液呈弱碱性。
在热空气中,它能缓慢分解,放出一部分二氧化碳;加热至270℃时全部分解放出二氧化碳:;
它也能与酸(如盐酸)作用放出二氧化碳:
小苏打的这些性质,使它在生产和生活中有许多重要的用途。在灭火器里,它是产生二氧化碳的原料之一;在食品工业上,它是发酵粉的一种主要原料;在制造清凉饮料时,它也是常用的一种原料;在医疗上,它是治疗胃酸过多的一种药剂。
大苏打
大苏打是硫代硫酸钠的俗名,又叫海波(Hypo的音译),带有五个结晶水(Na2S2O3・5H2O),故也叫做五水硫代硫酸钠。
大苏打是无色透明的晶体,易溶于水,水溶液显弱碱性。
它在33℃以上的干燥空气中风化而失去结晶水。在中性、碱性溶液中较稳定,在酸性溶液中会迅速分解。
大苏打具有很强的络合能力,能跟溴化银形成络合物。反应式:,
根据这一性质,它可以作定影剂。洗相时,过量的大苏打跟底片上未感光部分的溴化银反应,转化为可溶的Na3[Ag(S2O3)2],把AgBr除掉,使显影部分固定下来。
大苏打还具有较强的还原性,能将氯气等物质还原。
,所以,它可以作为绵织物漂白后的脱氯剂。类似的道理,织物上的碘渍也可用它除去。
另外,大苏打还用于鞣制皮革、电镀以及由矿石中提取银等。
从上面的介绍可知,“三姐妹”的名字虽然只有一字之差,但它们的性质和用途却又如此不同。在使用它们时,要名实统一,避免张冠李戴。
纯碱_碳酸钠 -市场现状
2012年我国碳酸钠产能区域分布
2012年华东地区碳酸钠产量占全年总产量的40%,华北占21%,华中地区占19%,相比2011年增长5个百分点。
受平板玻璃行业产能过剩,需求量减少影响,2012年平板玻璃消费比例略有下降,占总消费额的34%,日用玻璃行业需求保持平稳,化工行业需求上升较快。[
诺美观点:未来我国将鼓励对产业升级有重大作用的大型碳酸钠企业,通过技改项目、重组等方式做大做强,并对新建项目严格控制,新建项目进入风险加大。
 爱华网
爱华网