电解水实验是一个测试水的组成实验,是一个重要的实验。根据电解时生成物的情况,电解可分为电解水型、分解电解质型、放氢生碱型、放氧生酸型等几种类型。水由氢、氧两种元素组成。水通电生成氢气、氧气。正极产生的是氧气,负极产生的是氢气。化学反应前后,元素种类不变。在化学变化中,分子可分成原子,而原子不可分,可构成新的分子。
电解水实验_电解水实验 -实验装置
水分子 H2O
氧分子 O2
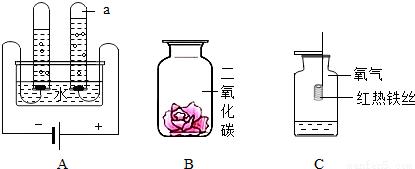
A试管里为氢气,B试管里为氧气。
【为增强水的电解性,可在水中加入少量稀硫酸、氢氧化钠溶液(一般不加氢氧化钠溶液,容易起泡沫)、硫酸钠溶液、硝酸钾溶液等】二氧化碳可以用来灭火。
电极(阳极必须为惰性电极,否则电极溶解而收集不到氧气,可以用铅电极)
电解水实验_电解水实验 -实验现象
试管内有气泡,与电源正极(氧气),负极(氢气)相连的试管产生的气体比值:1:2(熟记口诀:氢二氧一,阳氧阴氢)
但在一般情况下,氢气与氧气的体积比值一般大于2:1,原因有下面两种 :
1.氢气和氧气的溶解性的差别,氢气难溶于水,氧气不易溶于水(1L水30mL的氧气)但一小部分氧气溶于水,比值大于2:1.
2.电极氧化消耗了一部分氧气
ρO2=1.429g/mL , ρH2=0.089g/mL
(其中氢,氧两种分子数比值:2:1;氢气,氧气的质量比值:1:8;氢元素和氧元素的体积比:2:1)
有八个字简单概括是:正氧负氢。氢二氧一。
上述实验中发生的化学反应属于分解反应。
在上图的装置里,我们可以知道氢气多的是负极,少的则是氧气。氢多氧少
电解水实验_电解水实验 -方程式
方程式
符号表达式:
(通电)
文字表达式:水→氢气+氧气
结论
水由氢、氧两种元素组成。(注意:电解水实验是产生氢气和氧气,不能说水由氢气和氧气组成,两者是不能相互交换的)
水(分子)中,氢、氧两种元素的原子个数比为2:1,分子个数比2:1体积比为2:1 质量之比为1:8
水通电生成氢气、氧气。
正极产生的是氧气,负极产生的是氢气。
化学反应前后,元素种类不变。
在化学变化中,分子可分成原子,而原子不可分,可构成新的分子。
有时实验结果不准确,原因如下:
1、氢气与氧气在水中的溶解度不同;
2、气体在电解器壁上的附着程度不同;
3、有副反应发生,消耗氧气。
电解水实验_电解水实验 -注意事项
⒈纯水不导电,可在水中加入少量硫酸钠或氢氧化钠或稀硫酸增强导电性。
⒉在实验进程刚开始时,氧气和氢气的体积比与1:2不符,是因为氧气不易溶于水,但会溶解一小部分;氢气难溶,反应速率较慢,所以氢气较少。
3.一定要将电解槽中的空气排尽,关闭活塞。
电解水实验_电解水实验 -如何验证
如用排气法收集,则要用拇指堵住试管口一会儿,(试管口朝下)使试管内可能尚未熄灭的火焰熄灭,收集好后,用大拇指堵住试管口移近火焰再移开,声音很小则表明氢气很纯。如果听到尖锐的爆鸣声,表明氢气不纯。这时需要重新收集和检验。氢气能够燃烧,可用燃烧着的小木条检验氢气,氢气燃烧时发出淡蓝色火焰,可能你会看见是黄色火焰,是因为装有氢气的容器中含有其他的化学物质,一般是元素钠的黄色。
电解水实验_电解水实验 -如何区分
能使带火星的木条复燃的是氧气,氢气可用燃着的木条。氢气燃烧会产生淡蓝色的火焰。(如果氢气太少可能只会有“扑”一声,不会燃烧)
电解水实验_电解水实验 -口诀
正氧、负氢(争养父亲)正氧体小能助燃;负氢体大能燃烧。
 爱华网
爱华网