系统性红斑狼疮性肾炎(systemic lupus erythenlatosus nephritis,SLEN)是指有肾病临床表现和肾功能异常,或仅在肾活检时发现有肾小球肾炎病变的系统性红斑狼疮患者。系统性红斑狼疮是一种公认的自身免疫性疾病,其病变大多累及数个系统或器官。儿童LN病变往往严重,难治病例较多。SLE部分病人以肾外症状为主肾损害轻;另一部病人则以肾损害为主要表现,肾外症状不明显,后者易误诊为原发性肾小球疾病。
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -流行病学
系统性红斑狼疮性肾炎本病多发于青少年女性,男女比例为1∶7――1∶9。60%以上病人年龄为15――40岁,儿童发病高峰年龄在10――14岁之间约1/3病儿为5――10岁极少发生于婴幼儿人群总发病率无确切资料国外资料估计在6.5/10万――48/10万之间,黑人与亚裔人群发病率较高,国内发病率约70/10万。肾脏病变在SLE病人中很常见,约40%――70%SLE患儿有狼疮肾炎(lupusnephritis,LN)的临床表现。肾活体组织检查一般病理检查发现肾病变者可达90%,进一步作免疫荧光及电镜检查发现有不同程度肾病变者近100%,LN患儿约占在全部LN病人的4%――10%。
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -病因
SLE病因尚未阐明,多数学者认为是有一定遗传特征的个体。在多种触发因素(如感染理化环境因素)作用下,发生免疫紊乱所致的自身免疫性损伤,LN具有明显的免疫复合物性肾炎特征。遗传因素
遗传流行病学资料发现SLE具有家族聚集倾向,同卵双生子SLE发病一致率达25%――70%,明显高于异卵双生子(2%――9%)。本病患者近亲发病率也高,国外报道12%SLE患儿近亲中患有同类疾病,其他自身免疫性疾病发病率也高于人群总发病率。但大量的遗传病学研究分析,证实SLE是多基因遗传,位于第6对染色体中的多个基因位点与发病有关,尤其是遗传性补体基因缺陷(C1r,C1s,C2及C4等早期补体成分缺陷)。人类白细胞抗原(HLA)基因(HLA-B8、BWl5、DR2、DR3)T细胞表面抗原受体(TCR)基因、免疫球蛋白基因等经典免疫应答基因的多态性也与罹患SLE有关。其中日本人、中国人HLA-DR2位点频率增高,西欧血统白人HLA-DR2和(或)DR3位点频率增高中国南方汉人SLE发病与DRBl*0301及DQBl*0608有关,美国黑人与DRB1*1503,DQAl*0102和DQBJ*0602有关。但其他人群研究未发现HLA-Ⅱ类基因与SLE发病有如此相关性。进一步研究发现某些HLA-Ⅱ类基因位点多态性与SLE患者产生自身抗体有关,尤其是不同HLA-DQ等位基因所共有的多态性序列可能导致某种自身抗体的产生。如含高水平dsDNA抗体患者中,96%具有HLA-A-DQBl*0201(与HL,A-DR3和DR7连锁),DQBl*0602(与DR2和DRw6连锁)或DQBl*0302(与HLA-DR4单体型连锁)等位基因。另一些人发现抗心磷脂抗体阳性的SLE患者与HLA-DQBl*0301(DQW7)、*0302(DQW8)、*0303(DQW9)、*0602(DQW6)等位基因密切相关。因此推测SLE患病基因位于MHC区域,与HI,A-Ⅰ类、Ⅱ类基因呈连锁不平衡性。
正常情况下补体成分在免疫复合物的固定和有效清除中起着关键作用,这些成分因遗传基因缺陷而缺乏时,将导致免疫复合物在肾脏沉积而得病。但资料表明补体缺陷在SLE中并不多见,且补体缺陷者肾病变也常不严重,临床表现不典型,累及男孩多,因此它不代表多数SLE的发病特征,同时表明致SLE的遗传基因肯定具有多种复杂特征。
环境与感染因素
系统性红斑狼疮性肾炎(1)紫外线:紫外线被认为是触发SLE的病因之一实验发现紫外线(主要是紫外线290――320nm)可诱使皮肤角质细胞产生白细胞介素-1(IL-l)、IL-3、IL-6及肿瘤坏死因子(TNF);紫外线还可以减弱巨噬细胞对抗原的清除以及抑制T细胞活化;约有1/3的SLE患者对光过敏或紫外线照射后发病。资料表明紫外线可使细胞内DNA转化为胸腺嘧啶二聚体,使其抗原性增强,诱生抗DNA抗体。
(2)药物或化学物质:某些药物可促使SLE患者光过敏,如磺胺药四环素;有些药物可诱发产生自身抗体如普鲁卡因胺、肼苯达嗪等;有些香料、染料、染发水,烟火熏烤食品、菌类也可诱发SLE。有人认为这药物或化学物质与细胞核蛋白结合后,发生抗原性变性,也是引发机体自身免疫损伤的重要原因。
(3)感染:感染诱发SLE也研究较多。近年资料发现人类免疫缺陷病毒(HIV)感染者可发生SLE;感染单纯性疱疹病毒可引起患者血清Sm抗原浓度升高;SLE患者血清中常见多种病毒抗体滴度增加(如风疹、EB病毒、流感、麻疹等),尤其是C型RNA病毒。
3.内分泌因素:SLE患者多数为女性,且不论男女患者雌激素水平均增高雄激素水平降低。推测高水平雌激素可直接作用B细胞,使其活化,导致分泌自身抗体的活化B细胞大量扩增。在实验动物中发现雌激素可使其病情加重,而雄激素可使病情减轻。
4.自身组织抗原变异:紫外线照射、药物化学物质、病原感染等多种因素均可能破坏自身组织暴露组织隐蔽抗原或使正常组织抗原结构改变,激发机体自身免疫损伤。
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -发病机制
发病机制
肾炎有关SLE发病机制尚无一致结论,多数学者认为发病环节可能是多元性的。较为一致的结论是具有一定遗传趋向的个体,在某些触发因素作用下,发生以自身组织为靶目标的异常免疫反应。其最终免疫损伤的机制是T细胞功能紊乱,B细胞多克隆活化,自身抗体与自身组织抗原结合后发生免疫复合物性疾病,LN更具有免疫复合物性炎症的明显特征。(1)T细胞功能紊乱:SLE患儿细胞免疫功能低下,T细胞亚群间失衡,T细胞绝对数减少,主要是T抑制细胞绝对数减少,且其程度与疾病活动性有关T细胞对B细胞的调控功能异常,致病性B细胞克隆活性增强,自身抗体水平上升T细胞功能紊乱可能源自细胞内信号传递异常,如细胞黏附分子异常,引起细胞间相互识别,黏合,信号传递障碍等,可能在SLE发病机制中具有重要作用。
(2)B细胞多克隆活化:动物实验研究提示B细胞多克隆活化诱发产生过多的致病性抗DNA抗体,大量资料证明SLE患者在活动期有类似B细胞多克隆活化证据,且预示病情严重与疾病进展。
(3)免疫复合物致病:研究表明DNA-抗DNA抗体是引起肾脏损害的一对主要抗原抗体复合物(免疫复合物),除此之外Sm抗原、SSA抗原、肾小球基底膜(GBM)抗原、肾小管基底膜(TBM)抗原与相应的抗体结合形成的免疫复合物,均可能与肾组织损伤有关。且不同抗体的免疫复合物与不同类型肾损害有关;如抗RNP(核糖核蛋白)及Sm抗体阳性时肾损害者少但另有研究发现抗SSA、RNP及Sm抗体阳性时,多为膜性肾病;弥漫增殖性狼疮肾炎上述抗体阳性率均低或滴度低;高亲和力DNA抗体阳性及低补体血症者多为弥漫增殖性肾炎
除T、B细胞功能紊乱产生大量致病性自身抗体的直接损伤外,免疫复合物是一个重要的致病原因,其主要机制是:
①循环免疫复合物:抗体与各种抗原在循环中形成免疫复合物后,经循环沉积于肾脏由经典途径激活补体,吸引中性粒细胞,释放炎症介质,引起肾脏损害。
②原位免疫复合物:实验发现ssDNA对肾小球基底膜有亲和力,经循环ssDNA先植入肾小球,再吸引循环中的抗ssDNA抗体与之结合,在原位形成免疫复合物,激活补体,诱生炎症,这种肾炎常为膜性狼疮性肾炎。
③抗GBM、抗TBM抗体:这些抗体直接与肾组织(GBM、TBM)反应,引起肾损伤,若发现免疫荧光在GBM呈线样IgG沉积,提示狼疮肾炎因抗肾组织抗体介导而致病。
④免疫复合物清除障碍:正常人可以通过多种途径清除不断产生的免疫复合物其中补体途径最为重要SLE患者因C3缺乏或红细胞膜上C3b受体减少,导致巨噬细胞清除机制减弱,是免疫复合物沉积,致病的重要原因。
病理改变
医学常识狼疮肾炎病变既可累及肾小球,也可累及肾小管以及肾血管及间质。其病变程度、范围、类型因人而异,至今尚缺乏一种完善的病理分类形式。儿童狼疮肾炎多使用WHO分类法及国际小儿肾脏病科研协作组(ISKDC)分类法并用Pirani积分法作为补充,且Pirani积分法较病理分型更能反映肾病变的严重性和活动性也能反映狼疮肾炎的治疗效果。
(1)WHO病理分型:括弧中为国际小儿肾脏病科研协作组(ISKDC)分类法。
①WHOⅠ型(ISKDC1a,1b):本型罕见为正常肾小球或轻微病变,极少部分患儿免疫荧光或电镜下可见肾小球有少许沉积物。
②WHOⅡ型(ISKDC2a,2b):系膜增殖型肾小球肾炎,病变局限于系膜区,表现为程度不等的系膜细胞和基质增多系膜区免疫沉积物阳性仅有轻度节段性系膜增生者为2a型,系膜和系膜细胞增生为2b型。本型多表现为轻度血尿或蛋白尿,很少发生肾功能不全。
③WHOⅢ型(ISKDC3a,3b和4a):局灶节段增殖型肾小球肾炎,部分肾小球存在急性或慢性病变,如节段性细胞增生、细胞坏死、内皮细胞增生、纤维素样坏死、白细胞浸润、透明血栓、系膜区和毛细血管壁见IgG、IgA、Clq、C3C4、白细胞介素等沉积约半数以上肾小球正常。临床上可表现为蛋白尿、血尿,高血压和轻度肾功能不全,亦可为肾病综合征。ISKDCAa指50%以上肾小球受累。
④WHOⅣ型(ISKDC5a,5b):弥漫增生性肾炎、狼疮肾炎中半数以上是本型,病变广泛且严重,几乎全部肾小球受累,呈活动性毛细血管内增殖性改变,中性粒细胞渗出,纤维素样坏死;毛细血管壁显著增厚,管壁内透明血栓;坏死节段常见细胞性新月体;严重病例呈弥漫性坏死和新月体性肾炎,部分病例呈不同程度肾小球硬化。免疫荧光见所有肾小球、肾小管、包氏囊及球外毛细血管基底膜有各种免疫球蛋白补体沉积,尤其是内皮下沉积明显,呈“满堂亮”现象不规则大块内皮下沉积物使光镜下见毛细血管襻僵硬毛细血管基底膜增厚呈“白金耳”现象(wireloops)。
本型还存在严重的小管间质病变,显著的单核细胞浸润,坏死性血管炎临床上本型患儿多为重症、血尿、蛋白尿、高血压肾病综合征、肾功能不全,如不给予积极治疗易进展为终末期肾功能衰竭。
⑤WHOⅤ型(ISKDC6):膜性肾病病变似特发性膜性肾病,表现为毛细血管襻的弥漫性增厚,后期基底膜增厚呈钉突样表现,但不同的是同时也见一定程度系膜与内皮细胞增生及系膜基质扩张。本型可进一步分为Ⅴa型:与原发性膜性肾病极似,细胞增生、浸润不明显;Ⅴb型:伴弥漫性系膜病变;Ⅴc型:伴局灶节段性细胞增生,浸润与硬化;Ⅴd型:伴弥漫增生性病变或新月体形成。a、b亚型较c、d亚型预后好,表明附加病变影响预后
⑥WHOⅥ型:肾小球硬化型,此型与其他肾小球疾病晚期硬化相似,常伴随以上各型肾小球病变,如局灶节段或弥漫增殖性病变。部分人表现为单纯肾小球硬化。
狼疮肾炎可以发生病理类型转化,如局灶增殖转化为弥漫性增殖,膜性肾炎转化为局灶节段增殖或弥漫增殖,系膜增殖可转变为局灶节段增殖等。
(2)肾小管及间质病变:狼疮肾炎中约50%――70%有肾小管间质病变常见于弥漫增殖型,也见于局灶型,少见于膜型肾炎,罕见于系膜增生型。病变以小管萎缩,小管基底膜增厚电子致密物沉积于小管基底膜及间质严重者出现小管坏死。
(3)肾小血管病变:常见以下几种类型:
①高血压引起的血管病变常见。
②小叶间动脉及出入球小动脉呈内皮细胞肿胀、破坏血管内血栓,IgG、C3沉积于血管壁,无炎症反应。
③坏死性小血管炎抗中性粒细胞质抗体(ANCA)阳性
④肾脏血栓微血管病(renalthromboticmicroangiopathy)在无坏死的基础上出现肾小动脉及间质毛细血管血栓,继而发展为肾小球硬化。
(4)活动性与慢性病变的判断:肾活检后可用半定量积分子方法评定病变情况,指导治疗。
①公认的活动性指标:有活动性病变者主张积极给予皮质激素,免疫抑制剂治疗如:
A.肾小球节段性坏死。
B.肾小球细胞明显增生。
C.基底膜铁丝圈样改变。
D.内皮下及系膜区较多电子致密物沉积核碎片及苏木素小体
E.细胞新月体
F.肾小血管病变。
G.间质广泛水肿及单核细胞浸润。
②慢性病变的证据:如肾小球硬化、纤维新月体肾小管萎缩、肾间质纤维化、肾小囊粘连、肾小血管硬化。
成年病人的资料认为这些慢性化指标,对预后的价值,就Ⅳ型病变而言有用,其五年存活率明显降低,重复肾活体组织检查动态观察意义更大。
(5)Pirani积分法:
①活动性病变:
A.毛细血管内增殖:(1+)<25%的肾小球受累;(2+)25%――50%的肾小球受累;(3+)>50%的肾小球受累。
B.白细胞渗出:(1+)轻度;(2+)中度;(3+)重度。
C.核崩解及纤维素样坏死:(1+)<25%的肾小球受累;(2+)25%――50%的肾小球受累;(3+)>50%的肾小球受累。
D.细胞性新月体:(1+)<25%的肾小球受累;(2+)25%――50%的肾小球受累;(3+)>50%的肾小球受累。
E.白金耳及透明血栓:(1+)少量;(2+)中等;(3+)重度。
②瘢痕性病变:
A.肾小球硬化:(1+)<25%的肾小球受累;(2+)25%――50%的肾小球受累;(3+)>50%的肾小球受累
B.纤维性新月体:(1+)25%――50%肾小球受累;(2+)25%――50%的肾小球受累;
(3+)>50%的肾小球受累。
C.肾小管萎缩:(1+)轻度;(2+)中度;(3+)重度。
D.间质纤维化:(1+)轻度;(2+)中度;(3+)重度。
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -临床表现
全身性表现
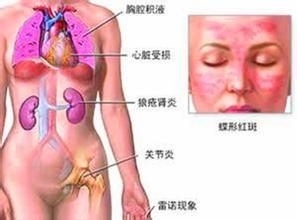
系统性红斑狼疮性肾炎临床表现多种多样,80%以上有发热,热型多样高热、低热间歇或持续发热。均有不同程度食欲不振、乏力和体重下降。
皮肤黏膜症状
70%――80%狼疮患儿有皮肤黏膜损害,典型的蝶形红斑仅见于50%病例,皮疹位于两颊和鼻梁为鲜红色边缘清晰,呈轻度水肿性红斑可见毛细血管扩张和鳞屑。炎症重时可见水疱、痂皮。红斑消退后一般无瘢痕,无色素沉着。其他皮肤黏膜症状
小儿盘状红斑较成人少,可见出血疹斑疹、网状青斑、荨麻疹、紫癜、口腔溃疡、鼻黏膜溃疡患儿日光照射后皮损加重或出现新的皮疹。约10%――20%病儿始终无皮疹表现。肌肉骨骼症状
约70%――90%病儿有关节、肌肉症状如关节炎关节痛,约1/3患儿伴有肌痛关节炎既可呈游走性,也可呈持续性,很少见关节破坏和畸形。心血管症状
可见心包炎、心肌炎、全心炎及各种小血管炎,雷诺现象在儿科少见。近年已开始注意有病儿发生冠状动脉炎及心肌梗死的病例。浆膜炎
30%患儿出现多浆膜炎,如无菌性胸膜炎、腹膜炎、急性狼疮性肺炎及肺出血。上述病变可表现为急性发热、呼吸困难、咳嗽、胸痛、胸腔积液;腹痛、腹泻、恶心、呕吐、腹水症,若发生肠道坏死、穿孔需外科治疗;严重肺出血可迅速死亡。血液系统症状
多有不同程度贫血,50%患儿外周血白细胞数减少,15%――30%患儿血小板减少,少数病儿以血小板减少为首发症状。神经系统症状
狼疮脑炎是SLE严重的并发症,相对发生率约30%(20%――50%)有5%患儿以神经系统症状为首发症状,表现为弥漫性脑功能障碍(意识、定向障碍,智能、记忆力下降,精神异常等)或局限性脑功能障碍,如癫痫脑血管意外偏瘫、失语。周围神经病变少见表现为多发性周围神经炎。其他症状
有肝脏肿大(75%)、肝功异常、脾肿大(25%)。浅表淋巴结肿大(约50%)。可出现巩膜炎、虹膜炎、视网膜炎等眼部症状。肾脏症状
狼疮肾炎在SLE中很常见,且是危及远期生命质量的关键因素。狼疮肾炎临床表现主要有以下几种形式。(1)轻型:无症状蛋白尿或(及)血尿,约30%――50%LN患儿表现此型,无水肿、无高血压仅表现为轻――中度蛋白尿(常<2.5g/d)和(或)血尿(2)慢性肾炎型:起病隐匿、缓慢进展的肾炎综合征,有不同程度肾功能不全、高血压
(3)急性肾炎或急进性肾炎综合征:其中35%――50%患者有高血压,不同程度蛋白尿,尿沉渣中有较多红细胞管型,肾功能不全或衰竭。急性肾炎起病类似链球菌感染后急性肾炎。急进性肾炎起病类似其他急进性肾炎表现为急性进展的少尿性急性肾功能衰竭但这两种起病方式在LN中均少见。
(4)肾病综合征:此型约占LN总数的40%,临床上可表现为单纯性肾病综合征或肾病综合征伴明显肾炎综合征。
(5)肾小管损害型:肾小管酸中毒伴肾钙化结石、尿镁丢失,LN病人中约44%有不同程度肾小管功能损害。
临床类型间也可转变,当血尿、蛋白尿、肾功能减退、高血压加重时,均提示临床类型或病理类型发生转变,预后不良。
并发症
肾功能衰竭、高血压、癫痫偏瘫、脑血管意外、多发性周围神经炎、视网膜炎、腹膜炎胸膜炎、肺炎、肺出血、肠道坏死穿孔心包炎,心肌炎等等。系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -诊断
系统性红斑狼疮诊断本病诊断标准大多参考美国风湿病学会1982年提出的诊断条件在11项标准中符合4项或以上即可诊断本病。国内成人多中心试用该标准特异性为96.4%,敏感性为93.1%主要漏诊的是早期、轻型不典型病例。中华风湿病协会1987年提出的标准增加了低补体C3、皮肤狼疮带试验及肾活检特征后,其诊断特异性为93.6%,敏感性提高到97.5%,并可早期发现以原发性肾病综合征起病的患者。系统性红斑狼疮诊断标准(美国风湿病学会修订1982):1.颊部红斑:遍及颧部的扇平或高出皮肤的固定性红斑,常不累及鼻唇沟部位。
2.盘状红斑:隆起红斑上覆有角质性鳞屑和毛囊栓塞,旧病灶可有皮肤萎缩性瘢痕。
3.光敏感:日光照射引起皮肤过敏。
4.口腔溃疡:口腔或鼻咽部无痛性溃疡。
5.关节炎:非侵蚀性关节炎累及2个或2个以上的周围关节,特征为关节的肿、痛或渗液。
6.浆膜炎:①胸膜炎:胸痛胸膜摩擦音或胸膜积液;②心包炎:心电图异常,心包磨擦音或心包积液。
7.肾脏病变:①蛋白尿>0.5g/d或>+++;②细胞管型:可为红细胞、血红蛋白、颗粒管型或混合性管型。
8.神经系统异常:①抽搐:非药物或代谢紊乱如尿毒症、酮症酸中毒或电解质紊乱所致;②精神病:非药物或代谢紊乱,如尿毒症、酮症酸中毒或电解质紊乱所致
9.血液学异常:①溶血性贫血伴网织细胞增多;或②白细胞减少<4×109/L至少2次;或③淋巴细胞减少<1500/μl,至少2次;或④血小板减少<100×109/L(除外药物影响)。
10.免疫学异常:①LE细胞阳性;或②抗dsDNA抗体阳性;或③抗Sm抗体阳性;或④梅毒血清试验假阳性免疫荧光抗核抗体滴度异常或相当于该法的其他试验滴度异常,排除药物诱导的“狼疮综合征”。
11.抗核抗体:免疫荧光抗核抗体滴度异常或相当于该法的其他试验滴度异常,排除药物诱导的“狼疮综合征”
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -鉴别诊断
鉴别诊断注意与其他风湿性疾病如幼年类风湿性关节炎全身型多关节型皮肌炎、硬皮症、混合性结缔组织病、多发性血管炎等鉴别。本病也易与各类肾病、心脏病溶血性贫血、血小板减少性紫癜、组织细胞增多症、慢性活动性肝炎及神经系统疾病混淆,注意鉴别。系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -检查
实验室检查:1.尿液检查:蛋白尿血尿及细胞、蛋白管型常见。
2.血液检查:大多有不同程度贫血,部分人白细胞减少血小板减少,90%以上患者血沉明显增快,血白蛋白降低球蛋白升高,以球蛋白升高为主但若有重度蛋白尿,球蛋白绝对值也降低。
3.免疫学检查
(1)抗核抗体(antinuclearantibodies,ANAAs):若免疫荧光分析ANA呈周边型对SLE诊断最有意义,提示dsDNA抗体阳性,该抗体对SLE有高度特异性且与疾病活动性相关
(2)抗双链DNA(dsDNA)抗体:直接检测dsDNA抗体阳性率为50%――80%,但特异性大于90%,且往往提示有肾脏损害,偶见于干燥综合征、类风湿性关节炎及活动性肝炎。
(3)抗Sm抗体:约25%――40%病人抗Sm抗体阳性但其特异性可达99%。
(4)其他自身抗体:抗单链DNA(ssDNA)抗体,阳性率高,特异性不强,26%――45%病人抗核糖核蛋白(RNP)抗体阳性但特异性不高抗干燥综合征(SS)A、B抗体敏感性、特异性均差。有坏死性血管炎时抗中性粒细胞质抗体(ANCA)阳性抗心磷脂抗体阳性病例常见病情呈复发性,多发性动静脉栓塞,血小板减少及流产
(5)补体:C1q、C3、C4CH50在SLE活动期常降低。
(6)循环免疫复合物阳性。
4.狼疮细胞(lupuserythematosuscell,LEC)LEC在SLE病人中阳性率可达60%――85%,但也可见于其他结缔组织病。
5.狼疮带试验取材于暴露在阳光下的正常皮肤用直接免疫荧光检测表皮与真皮连接处,可见一条IgG和C3沉积的荧光带,80%活动期SLE病人阳性,其他自身免疫性疾病也可呈阳性。
6.肾脏穿刺检查:对系统性红斑狼疮的确诊率达100%,即使临床上没有出现肾脏异常,但肾脏活体组织检查也会发现异常。
7.其他如肝、肺、胃肠周围神经肌肉、滑膜等活体组织检查均有助于系统性红斑狼疮的鉴别诊断。
其它辅助检查:
常规做X线、B超心电图等检查
1.心电图有心肌病变,肺动脉高压病变,心包炎或电解质失调时,心电图有相应的异常改变。
2.放射线检查
(1)X线:可检查出系统性红斑狼疮患者的心包炎,胸膜炎,肺炎,肺部感染,肺出血,关节炎
(2)CT扫描和磁共振检查:对神经系统心、肺纵隔、腹部、盆腔、脊柱关节病变均有诊断或鉴别诊断价值。
3.超声波检查超声波对系统性红斑狼疮患者的浆膜炎、心肌炎、肝、脾、淋巴结肿大,胆囊、胰腺、肾脏,泌尿道、子宫、前列腺病变均有指导意义,也可做血管炎的检查。
相关检查:C3、C4、CH50免疫复合物、免疫球蛋白G 、抗Sm抗体、抗心磷脂抗体、抗核抗体、抗细胞胞质抗体、狼疮细胞、白蛋白、砷、脱氧核糖核酸染色、血小板、血沉。
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -治疗
糖皮质激素特别强调治疗的个体化。特别是要注意心、肾、神经系统并发症的及时干预治疗,充分考虑药物治疗的利弊、得失后确定近期远期的治疗方案并认真评价治疗风险与效益,让病儿监护人充分知晓。
1.一般治疗:急性期活动期,重症均强调休息、加强营养避免日晒静止期逐步恢复活动上学服免疫抑制剂期间尽量不到公共场所,减少感染机会,若发生感染应积极治疗,要避免使用诱发狼疮和肾损害的常用药物(磺胺、肼屈嗪、普鲁卡因胺对氨水杨酸、青霉素氨基糖苷类药物);局部皮损若无继发感染,可涂泼尼松软膏
2.免疫抑制剂
(1)糖皮质激素:是治疗SLE基本药物,主要作用于G0期淋巴细胞有强烈抗炎作用。常用量为泼尼松1――2mg/(kg・d),总量<60mg/d,3次/d,口服,病情缓解、实验室检查基本正常后改为隔天顿服病情稳定后可以减至小剂量(0.5――1mg/kg,隔天)长期用药,维持疗效临床发现多数狼疮肾炎患儿单用泼尼松治疗无效,尤其是Ⅳ型狼疮肾炎急进性狼疮肾炎肾上腺皮质激素治疗更不敏感。甲泼尼龙冲击治疗,每次15――30mg/kg,总量<1g/次,1次/d,3次一疗程,间隔1――2周可重复一疗程,共2――3疗程后用中、小剂量泼尼松维持治疗,可使部分狼疮肾炎患儿迅速缓解,肾功能较快好转。
糖皮质激素长期使用,易发生条件致病菌感染、骨质疏松高血压、水电解质紊乱、精神病、消化道出血等多种毒副作用。
(2)细胞毒类药物:很多观察均认为皮质激素联合细胞毒类药物治疗狼疮肾炎,疗效远较单用皮质激素或单用细胞毒类药物好联合用药还可大大减少皮质激素的用药量,提高疗效。常用的细胞毒类药物有环磷酰胺(CTX)、硫唑嘌呤、氮芥其中以环磷酰胺(CTX)使用最广泛,疗效最好。环磷酰胺(CTX)主要作用于S期对整个细胞周期均有作用,能有效抑制抗体产生,抗细胞毒、抗炎症介质作用也很明显,其免疫抑制效应强烈而持久。皮质激素联合环磷酰胺(CTX)[2――2.5mg/(kg・d)]对保存肾功能有明显作用。近年资料表明环磷酰胺(CTX)大剂量冲击用药,较口服环磷酰胺(CTX)不良反应更少肾脏保护效果更好。环磷酰胺(CTX)冲击方案尚未成熟,最积极的方案是每次8――12mg/kg,1次/d,连用2天1疗程,总量<1g/疗程,至少间隔2周用1疗程,连用6疗程后改为3月1疗程维持2年;也有每月1疗程,连用6月后停药的半年方案以及每月1次连用6月,再3月1次维持2年的长疗程治疗方案。1992年NIH研究小组报告的前瞻性研究结果认为,长疗程较半年疗程在保护肾功能方面疗效更好只有10%病人进入终末期肾衰环磷酰胺(CTX)大剂量冲击治疗应注意消化道副反应和采取水化措施[60――80ml/(kg・d)或2000ml/m2电解质平衡液持续静滴],防止出血性膀胱炎。目前尚无资料确切证明口服方案与冲击方案对性腺影响的大小。
(3)硫唑嘌呤:每天2.5mg/kg治疗严重弥漫增殖型LN,可减少皮质激素用量,与皮质激素联合口服环磷酰胺(CTX)效果相同。甲泼尼龙冲击治疗后可用小剂量泼尼松及硫唑嘌呤维持治疗。
(4)苯丁酸氮芥:0.2mg/(kg・d)分3次口服,疗程2――3月,其对性腺的不良反应与致癌作用并不比环磷酰胺(CTX)小
(5)环孢素:选择性作用于辅助性T细胞,间接抑制B细胞产生抗体,但毒副作用大,尤其是肾脏的毒副作用。一般仅在环磷酰胺(CTX)不能使病情缓解者选用环孢素;急性期用药5――7mg/(kg・d),维持用药4mg/(kg・d),可作为激素、细胞毒类抗凝剂三联用药的候选药物之一。
抗凝剂3.抗凝剂:狼疮肾炎病人多呈高凝状态,尤其是使用肾上腺皮质激素之后,血小板聚集力增强,血纤维蛋白原升高,不但可发生肾小球毛细血管血栓还易并发肾静脉等大血管血栓,应予抗凝治疗。严重弥漫增殖型LN可用肝素100U/kg,或蝮蛇抗栓酶0.01U/kg,<0.25U/次,1――2次/d静滴,或口服双嘧达莫(潘生丁)3――8mg/(kg・d)。有肯定血栓形成者可用尿激酶每次200――600U/(kg・次),溶于葡萄糖水200ml中静滴,1次/d,14天一疗程。
4.血浆置换:可清除部分致病性抗体抗原及免疫复合物,但价格昂贵,多用于对其他治疗无反应的严重LN患儿,对狼疮脑患儿效果较好。也有人主张在急进性LN患儿给甲泼尼龙冲击治疗同时给予血浆置换疗法,每天置换2――4L,连续3天。
5.静脉注射用人血丙种球蛋白(MG):IVIG对部分狼疮患儿有一定疗效、可抑制B细胞产生抗体,可改变抗体、抗原比例,使免疫复合物易于清除可使部分环磷酰胺(CTX)耐药的患儿病情缓解
6.全身淋巴结X线照射:有报告用X线照射全身淋巴结(20Gy/4――6周),可使部分病人取得一定疗效,肌酐清除率好转,dsDNA抗体减少,甚或停用泼尼松。
7.抗CIM单克隆抗体:可使T细胞数下降,B细胞抑制,蛋白尿减少,血浆蛋白升高
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -预后预防
预后
预防早年LN患儿多死于尿毒症,病死率达60%――80%因正确诊断,分型及诊疗手段改变其病死率已下降至18.9%――25.4%。下列因素可能影响预后:
1.临床表现:持续大量蛋白尿血尿、高血压、贫血血肌酐水平已升高者预后不良反复感染也影响预后。
2.病理类型:Ⅰ、Ⅱ型一般不发展为终末期肾预后不良者多死于并发症;Ⅲ型可能发展成慢性肾功能衰竭,但5年存活率仍达75.8%Ⅳ型病情危重,预后不良,但及时正确治疗5年生存率可从25%提高到80%。Ⅴ型若有附加增生性病变(c、d亚型)预后不良,与Ⅳ型相似。公认有大量内皮下电子致密物沉着、合并血管病变、肾功能恶化需替代治疗者预后恶劣。
3.其他家长、病儿对治疗目标的理解和支持以及环境因素也同样影响预后。
预防
预防红斑狼疮性肾炎复发预防复发的主要措施:
1.早期明确诊断,及时正确治疗,长期定期随访,根据病情变化,调整用药剂量。
2.避免诱发因素
(1)日光曝晒、紫外线照射。
(2)寒冷刺激可导致本病复发避免寒冷刺激以防受凉。
(3)有的药物与发病明显有关如青霉素、磺胺类、保泰松、肼屈嗪(肼苯哒嗪)、普鲁卡因胺、氯丙嗪、苯妥英钠、异烟肼、口服避孕药等,可使处于缓解期的红斑狼疮患者进入活动期和实验室改变。
(4)系统性红斑狼疮与妊娠有互相不利影响,如胎儿异常、流产、早产或死胎。反之,妊娠可使患者在怀孕末3个月和产后数月内病情加重或复发
3.及时抓住复发的早期征兆:如原有的症状关节痛、发热、乏力等重新出现应及早就诊进行必要的检查,如有活动应及时采取措施,及早进行药物治疗和给予中药治疗。
4.食物宜清淡、易消化,不宜过食油腻厚味之物;合理采用补益精血的食物,如鱼、肉、蛋、鲜果等,有益于本病的治疗、康复。病情稳定期间,适当参加体育活动,以增强体质。
5.进行心理治疗:保持良好情绪对疾病的转归非常重要。保持良好的情绪状态,维持免疫功能的相对稳定,是避免复发,早日康复的重要保证。
系统性红斑狼疮肾炎_系统性红斑狼疮性肾炎 -日常注意
运动调整情绪系统性红斑狼疮肾炎的女性朋友往往会情绪低落,焦虑、忧郁、气愤、罪过、否认、忧郁等情况接钟而来。要打赢那场战争,保持心情的愉快,有助于病情的改善。同时亲朋好友要给予关爱和支持。
饮食狼疮性肾炎病人应摄取足够的营养,如蛋白质、维生素、矿物质,以清淡为宜。水份、盐份宜作适度限制。避免多量的烟、酒或刺激性食物。骨质疏松可以使用维生素D。
运动运动可以促进血液循环,增进心肺功能,保持肌肉、骨骼的韧性。但是不要过度疲劳.但关节发炎则不适宜活动。
避免日晒系统性红斑狼疮肾炎患者对阳光敏感,是紫外线的β波长所造成的,应尽量避免日照。
 爱华网
爱华网