发布时间:2024年11月06日 17:01:29分享人:清新少女贩卖机来源:互联网30
以电势E为纵坐标,pH为横坐标描绘元素-水系中各种反应的平衡条件图。
电势_电势-pH图 -电势-pH图
电势_电势-pH图 -正文
以电势E为纵坐标,pH为横坐标描绘元素-水系中各种反应的平衡条件图。在湿法冶金的浸取过程和金属腐蚀的研究中,经常应用这种图。电势-pH图是在40年代末为比利时普巴(M.Pourbaix)所首创,有关文献常称为普巴(Pourbaix)图。
反应类型 元素-水系中发生的反应可分为两类:
① 有电子得失的还原-氧化反应可表示为:pOx+nH++ze
qRed+cH2O (1)
式中Ox和Red分别代表物质的氧化态和还原态;p、q、n、c为化学计量系数;z为电子e的迁移数。
式(1)所示半电池反应的平衡电极电势E,可按涅斯特(Nernst)公式计算,即式中E°称为标准电极电势,可由参与反应的各物质的标准化学势计算,其值与温度及压力有关;aOX和aRed分别为物质氧化态和还原态的活度,a
照例取为1;R为气体常数,其数值是8.314焦/(摩・开);F为法拉第常数96490(库仑/摩)。反应(1)的平衡条件描绘在电势-pH图上时,可得到斜率为
的一条直线,但此直线的位置只有在已知压力、温度以及aOX和aRed的条件下才能够确定。所以,任何电势-pH图的绘制都以指定的压力、温度以及除H+以外的其他物质的活度条件为前提。
如果没有H+参与半电池反应,则还原-氧化反应可写成pOx+ze
qRed (2)
这是反应 (1)在n和c皆为零时的特例。此半电池反应的平衡电极电势为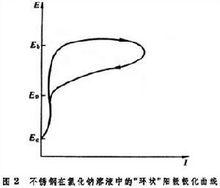
即反应(2)的平衡条件在指定压力、温度以及aOX和aRed下仅决定于电势而与pH无关,从而描绘在电势-pH图上为一根水平线。
②无电子得失的非还原-氧化反应可表示为aA+nH+
bB+cH2O (3)
式中A、B分别为反应物与生成物;a、b、c、n均为化学计量系数。此反应的自由焓变量ΔGT可按下式计算:反应平衡时ΔGT=0,又a
=1,于是因为ΔG
爱华网本文地址 » http://www.413yy.cn/a/8103230103/20242.html
更多阅读
苹果手机怎么省电【有图有文】——简介我们使用iphone手机的时候,会感觉电用的很快,有时候待机一晚上就没电了,其实这是因为开了一些不必要的程序,现在就分享给大家iphone手机如何省电苹果手机怎么省电【有图有文】——工具/原料iphone

一图看懂电力改革发改委年底拿出新电改方案 各方仍在博弈2014年10月20日企业观察报消息称电改方案力度没有报道那么大 不会

国内首款电动微型车 康迪小电跑正式面世(图)http://www.sina.com.cn2009年09月18日10:31新浪汽车综合图为康迪小电跑 每年全球有约80万人死于城市空气污染,日益恶劣的生存环境使人们对满大街尾气肆虐的汽油车深恶痛绝。全世界都在
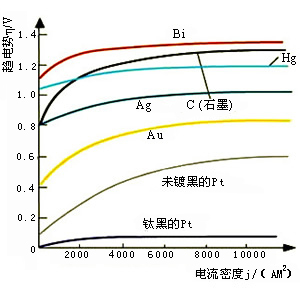
简单与复杂电极反应标准电极电势值间的关系与简单电极反应不同,当电极反应中不仅有某氧化态及某还原态物种,同时还与沉淀平衡、或配合平衡、或电离平衡等有关时,这种电极反应可被称为复杂电极反应。复杂电极反应的标准电极电势计算

:电极的本性、氧化型物种和还原型物种的浓度(或分压)及温度。对于任何给定的电极,其电极电势与两物种浓度及温度的关系遵循能斯特方程(Nernstequation)。设有电极反应 :Ox ze - Red则有 :(1)(1)式称为能斯特方程。式中,z表示电极反应中

 爱华网
爱华网



