参考五:PI染色检测细胞周期protocol
1、离心收集细胞,弃上清,用预冷PBS洗细胞两次。
2、加入预冷70%乙醇,于4℃固定过夜,或-20℃长期固定(4℃过夜一般隔天就进行检测,如果想推迟几天测,那就保存在-20℃,有资料说-20℃可以保存一个月,个人建议尽量在最短时间内检测,有些实验是在不同时间点上收细胞,这时我就等最后一次固定完了一块测,基本上也多在一周内检测完毕,没有特地去比较保存时间对检测结果的影响)。
3、细胞染色
离心收集细胞,以1mL的PBS洗细胞一次,加入500uLPBS含50ug/mL溴化乙锭(PI),100ug/mL RNaseA, 0.2% Triton X-100,4℃避光孵育30分钟(PI我是直接用PBS配成工作浓度,然后加入细胞沉淀混匀,RNA酶现加,但有时不加发现对实验结果也没太大的影响)。
4、流式分析
以标准程序用流式细胞仪检测,一般计数2-3万个细胞,结果用细胞周期拟和软件ModFit分析。
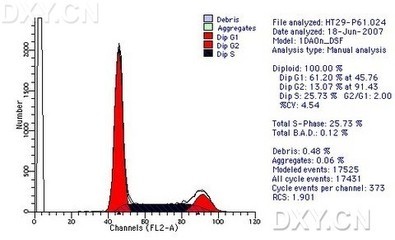
分析时,使用FL2-w和FL2-A显示,去除联体细胞,具体如下图。
细胞周期流式后一般分为G0/G1,S,G2/M期三部份,如果有凋亡,在G0/G1期前面有个凋亡峰(也称sub-G0期),而如果分析时细胞窗口没设置好,可能在最前面还有细胞碎片峰。
结果解读
G0/G1期细胞占总的61.2%,峰位于横座标的45.76
G2/M期占13.07,峰位于横座标的91.43
S期占25.73
G2/G1为2.0(即G2期为4倍体细胞,而G1期为2倍体细胞,比值为2)
峰的变异系数为4.54%(好)
细胞碎片为0.48%,细胞聚集体有0.06%。
总的细胞数(仪器检测到的)为17525个,
在细胞周期中分析的细胞数为17431个(即排除了碎片及聚集体后)
CV是变异系数。一般CV越小,峰形越好,越尖锐。能控制在5%左右是比较好的结果,一般小于10%就可以认可了。
注意事项
细胞凋亡时,其DNA可染性降低被认为是凋亡细胞的标志之一,但这种DNA可染性降低也可能是因为DNA含量的降低,或者是因为DNA结构的改变使其与染料结合的能力发生改变所致。在分析结果时应该注意。

 爱华网
爱华网