在苯酚教学中,有一个实验:往苯酚钠溶液中通入少量二氧化碳出现白色浑浊,请学生根据实验现象写出反应的化学方程式,学生不假加思索地写出:
2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3
然后教师指出这个方程式是错误的,并用实验佐证:往苯酚溶液中滴加适量碳酸钠溶液,白色浑浊消失,以此证明两者因发生化学反应不能共存,进而从理论上进一步解释:H2CO3是二元弱酸,其电离常数(室温时,注:本文采用的电离常数均为室温时)一级电离常数K1=4.3×10-7,二级电离常数K2=5.6×10-11,而苯酚的电离常数K=1.28×10-10,说明酸性强弱:H2CO3>C6H5OH>HCO3-,也就是说,苯酚的酸性介于H2CO3和HCO3-之间,所以,无论往苯酚钠溶液中通入的二氧化碳是少量还是过量,反应总是为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,而在高中化学中强酸可以制弱酸,这个原理可谓深入人心,因为在初中的化学学习中就已经学习并使用这一原理,如实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑。这种解释无可厚非,大多数教师在教学中也采用了这种解释。
此处有一疑问:按照这种解释,次氯酸与碳酸钙也不能共存。化学必修1(苏教版)教材中,工业上漂白粉漂白原理,Ca(ClO)2溶液与CO2的反应,方程式为:
Ca(ClO)2+CO2+H2O=CaCO3↓+HClO,按照上述原理,由于HClO的电离常数K=2.95×10-8与H2CO3一级电离相比,酸性较弱,但与HCO3-相比,酸性较强,即酸性强弱为:H2CO3>HClO>HCO3-据此CaCO3应与HClO继续反应生成Ca(HCO3)2才对啊?也就是说无论次氯酸钙溶液中通入的二氧化碳是少量还是过量,反应方程式均为:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO难道教材出错了,我想会思考的学生在老师教授了二氧化碳与苯酚钠的反应原理后回过头思考这个问题时可能也有这样的疑惑,如果这个反应不是这样进行的,那产物又该是什么呢?HClO是肯定有的,这样才能漂白啊,这是铁定事实!难道是先生成了Ca(HCO3)2和HClO,然后Ca(HCO3)2自行分解为CaCO3?并且可以理解为,无论通入二氧化碳的量是多少,反应产物应该是相同的。
但是在查阅资料的过程中,却发现很多资料,包括大学教材中显示:当在Ca(ClO)2溶液中通入少量CO2时反应为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,只有当通入过量CO2时反应才是Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO且大多数教师在教学中也默认了这种说法,难道教材用的是双重标准,我想这可能也是一些老师的困惑,尽信书则不如无书,不能因为教材是权威就丧失批判精神,对此将前人的研究在此分享:
1.实验验证
所用药品:大理石、稀盐酸(1 mol·L-1)、漂白粉
实验步骤:①用启普发生器制得二氧化碳气体,并立即通入漂白粉制得溶液中去;
②继续通入二氧化碳气体,观察实验现象。
实验现象:当二氧化碳通入次氯酸钙溶液中立即生成白色沉淀,持续通入二氧化碳,沉淀溶解,溶液澄清。
实验结论:少量的二氧化碳通入次氯酸钙溶液中生成碳酸钙,过量的二氧化碳生成碳酸氢钙。
2.理论解释
单纯用强酸制弱酸的原理已经无法解释这个问题了,事物的发展变化应是多方面的原因造成的。
沉淀溶解平衡理论:当在Ca(ClO)2溶液中通入少量CO2时反应为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,CaCO3存在如下平衡:CaCO3(s)Ca2+(aq)+CO32-(aq)在此我们忽略了HClO是弱酸的事实,由于HClO电离出的H+量少,而CO32-量少,浓度亦小,少量的H+和CO32-可以共存,CaCO3的沉淀溶解平衡未被足够地向右拉动,故少量CO2通入Ca(ClO)2溶液中应生成CaCO3。
水解理论:Ca(ClO)2溶液中存在水解平衡:
Ca(ClO)2+H2O=Ca(OH)2+2HClO;(1)
向该溶液中通入CO2,可能发生下列反应:
CO2+Ca(OH)2=CaCO3↓+ H2O,促进Ca(ClO)2水解,生成HClO:
Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO;(2)
次氯酸钙溶液中通入少量CO2,生成CaCO3,而不是Ca(HCO3)2,说明反应(1)占主导,是CO2促进Ca(ClO)2水解的结果。
3.结论
少量CO2通入Ca(ClO)2溶液中,反应为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
过量CO2通入Ca(ClO)2溶液中,反应为:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO
强酸制弱酸的原理本身没有错,但是当生成物中有难溶物时,生成弱酸与生成难溶物存在竞争,竞争结果是生成难溶物。
4.几点拓展
4.1:CO2(无论少量或过量)通入NaClO溶液中发生反应的方程式为:
NaClO+CO2+H2O=NaHCO3+HClO,因为酸性大小为:H2CO3>HClO>HCO3-
4.2:已知Al(OH)3电离常数K=5.01×10-9,少量CO2通入NaAlO2溶液中则发生反应的方程式为:NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3,因为由电离常数得出酸性结论:
H2CO3>Al(OH)3>HCO3-
而实则不然,产物却是Na2CO3,接下来我们来看一个假设,假设少量CO2通入NaAlO2溶液中发生反应:NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3,而我们知道:
NaAlO2+NaHCO3+H2O=Al(OH)3↓+Na2CO3,证明假设不成立,而此时又是弱酸制强酸。看来强酸制弱酸的原理并不是万能的。
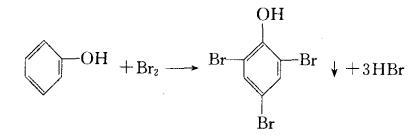
4.3:H2S气体通入到CuSO4溶液中发生反应为:CuSO4+H2S=CuS↓+H2SO4这是一个典型的弱酸制强酸的例子,反应能进行的原因:生成物中生成了难溶性的CuS,而CuS的溶度积Ksp=8.5×10-45,说明CuS很容易生成,只需要提供少量的硫离子,便能与大量的铜离子结合成CuS沉淀。在这个离子反应中,强酸制弱酸可以看作反应向着离子浓度减小的方向进行,而在CuSO4与H2S的反应中,因为生成了溶度积极小的CuS,使溶液中的离子浓度更小,反应就易向生成CuS的方向进行了。
综上所述:若生成物为可溶于水的碳酸氢盐,则可以用强酸制弱酸的原理分析,若生成物为难溶物或不溶物,则以生成难溶物或不溶物为主,即使是弱酸也可以制强酸,强酸制弱酸的原理来解释这个问题就显得苍白无力了。
其实很多反应的顺利进行都可以从不同方面进行分析,各种反应事实的存在也往往是由于不同方面的原因在不同的条件下所起的作用的权重比例不同。当在一定条件下,某一方面的原因起了主要作用,反应的事实就表现为某一事实。
学会思考是新课改的教育目标之一,而只有会思考的教师才能有意识地培养学生的思考能力。在教育教学中,我们会源源不断的碰到各种问题,只要我们勇于思考和实践,问题就会成为我们进步的阶梯。美国著名学者波斯纳(Posner)提出教师成长的公式:成长=经验+反思。新课程教学呼唤教师从单纯的知识传递者走向研究者、反思者,也就要求新时期的教师不仅专业学识要较为丰富,而且还善于对教学问题进行研究和反思。
 爱华网
爱华网



