惰性电极电解氯化亚铁溶液
长乐侨中 张劲辉
2013年高考福建化学中考查到了氯化亚铁溶液的电解(23题最后一问),同时天津高考化学第9题也有涉及,电解氯化亚铁溶液的电极反应是如何写的呢?
解释一:阴极:2H++2e-===H2↑
阳极:Fe2+-e-===Fe3+
总反应为:2Fe2++ 2H+==2Fe3++H2↑
因为Fe2+的还原性强于Cl—,所以阳极Fe2+放电,变成Fe3+。
解释二:阴极:2H++2e-===H2↑
阳极:2Cl—-2e-===Cl2↑
2Fe2++ Cl2===2Fe3++2Cl—
两个反应叠加得出阳极反应是Fe2+-e-===Fe3+
因为阴离子流向阳极,阳极肯定是Cl—放电,生成Cl2,Cl2再氧化Fe2+变成Fe3+。
虽然它们最后答案一样,其实本质不同,这两种不同的解释区别就在阳极是哪种离子放电,观点一认为是Fe2+,观点二认为是Cl—,答案是哪一个?你说呢?
下面文章是百度的,可供参考:http://www.e-huaxue.com/bbs/readbbs.asp?zid=5412&fid=4
在学习上述课程的同时,我和我的学生在电解氯化亚铁实验时遇到了一个关于阳极到底是氯离子放电还是亚铁离子放电的纠结问题。
实验现象如下:阳极(材料:石墨)溶液由浅绿色逐渐变为黄色,再出现红褐色胶状物质,随着时间的延长逐渐开始沉淀,没有出现气泡,湿润的淀粉KI试纸未出现蓝色。
学生甲认为:电解池阳极发生的是氧化反应,当阳极为惰性电极时,溶液中的Fe2+离子的还原性比Cl—离子强,理论上应该Fe2+离子先失电子生成三价Fe3+离子。
学生乙认为:当阳极是惰性电极时,阴离子(Cl—、OH—)向阳极定向移动,阳离子(Cu2+、H+、Fe2+)向阴极定向移动,所以阳极就是Cl—离子放电。
接着我对四种不同浓度氯化亚铁溶液进行惰性电极电解,结果几乎与上述相同,只是浓度不同时,出现明显现象的时间有所差异。
“这一现象能否说明甲的解释是正确的呢?”我有所顾虑,请教了同组的老师和各县市区的教研员,他们也没有十分的把握解释这一现象,然后,我又请教了大学老师,他们只能说没有产生氯气现象,可能是氯气产生后溶于水或者与亚铁离子反应,但也只是个人解释。因为我们的教材中电解是用“优先放电理论”解释的,且并未提及当惰性电极放电时,阳极就一定要阴离子放电、阴极就一定是阳离子放电。
通过翻阅大量资料我了解到,最新的电解理论不是“优先放电理论”,而是“曹天叙电解理论”,(http://wenku.baidu.com/view/5fbe7107cc17552707220846.html)
它明确定义“电解质溶于水或溶化时,在直流电源的作用下,电解质的阳离子在阴极发生还原,电解质的阴离子在阳极发生氧化的过程叫电解”。
1、电解任何一种电解质的水溶液和熔化液,都是电解质的阳离子在阴极发生还原,电解质的阴离子在阳级发生氧化,不因电解质离子的电极电势大小而改变,否定水的分子、离子在两极放电。
2、电解任何一种电解质的水溶液和熔化液,都是电解质的阳离子在阴极发生还原,电解质的阴离子在阳极发生氧化,电解过程活性阳电极的溶解,而是电解质的阴离子在阳极放电后与活性阳电极反应生成金属盐而溶解的,不是活性阳电极本身放电溶解。
3、电解电解质溶液时,如果有能在常温下与水反应的金属离子,在阴极放电后便会与水反应产生氢,例如K、Na、Li、Ca等。在常温下不与水反应的金属离子在阴极放电后沉积金属单质。例如Cu、Zn、Cr、Ni、Cd、Fe等。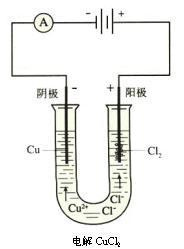
4、电解任何一种电解质的水溶液,都是电解质的阳离子在阴极发生还原,电解质阴离子在阳极发生氧化,不因过电位高低而改变。
5、电解任何一种电解质的水溶液,都是电解质的阳离子在阴极发生还原,电解质的阴离子在阳极发生氧化,不因电解质的离子浓度和电流高低而改变。
6、如果加入的电解质是强酸与弱碱组成的盐,水解后生成弱碱与强酸,电解时强酸的阳离子在阴极发生还原,强酸的阴离子在阳极发生氧化。如果加入的电解质是强碱与弱酸组成的盐,水解后产生弱酸与强碱,电解时强碱阳离子在阴极发生还原,强碱阴离子在阳极发生氧化。
 爱华网
爱华网