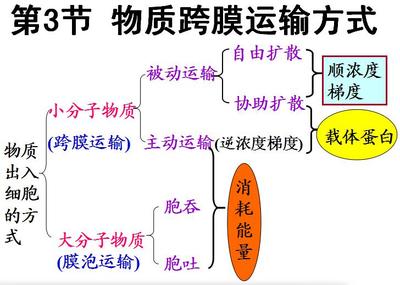
在初中阶段习惯将化学反应分为四种基本反应类型,即化合反应、分解反应、置换反应、复分解反应。而到高中接触到的反应绝大多数都是氧化还原反应,因此有必要让学生知道化学反应还有另一种分类方法,氧化还原反应和非氧化还原反应。
初学氧化还原反应,学生会感到很乱,如何能让学生轻松地学习这部分内容,这就需要教师有高超的教学技巧。我是按照如下的教学思路进行教学的。
一开始介绍几组概念:氧化还原反应、非氧化还原反应;氧化反应、还原反应;氧化剂、还原剂;氧化产物、还原产物;氧化性、还原性。接着介绍几组概念之间的关系,让学生展开讨论。从反应物开始分析,知道在反应中,还原剂失去电子,元素化合价升高,被氧化,发生氧化反应,得到的生成物为氧化产物;氧 化剂得到电子,元素化合价降低,被还原,发生还原反应,得到的生成物为还原产物。然后为了帮助学生记忆,可概括成六个字:失、升、氧,得、降、还。也可以发现在氧化还原反应中,存在很多规律。化学反应中,有氧化就有还原,有化合价升高就有化合价降低,有失电子就有得电子,而且得失电子总数一定相等,化合价升降总数一定相等。
经过学生讨论总结,氧化还原反应的宏观特征是元素化合价发生改变,而氧化还原反应的本质是电子转移。那么如何形象地表示反应中的电子转移呢?接着介绍双线桥表示方法。
在双线桥表示中,应强调两条线,一条是元素化合价升高,另一条是元素化合价降低,箭头指向生成物中对应元素,线条上要表示出电子转移个数。双线桥有一个明显的优点,能直观反映出还原剂、氧化剂、氧化产物、还原产物。初学时,学生往往线条指向不到位,电子数目不准确,开始时不要怕学生出错误,多让学生展示,让所有问题尽可能暴露出来,只有发现问题,才能解决问题。
本节课知识点较多,学生容易混乱,知识小结就显得尤为重要,经过小结,学生就有一个清晰的思路,对氧化还原反应的本质和特征也有一个更深刻的认识。当然氧化还原反应的学习还要穿插在以后的教学中,只有不断练习,学生的水平才能上一个台阶。
 爱华网
爱华网