1.取50—100mg的组织,加入1ml Trizol试剂,用匀浆器打匀(Trizol先放于冰上)。
2.将匀浆室温放置5min。
3.加入200μl氯仿,剧烈震荡混匀30s,冰上静置3min。
4.12000rpm,4℃离心15min。
5.将上清液小心转移到新的1.5ml离心管中(取400μl),加入等量体积的异丙醇,上下颠倒几次混匀,室温下放置15min。(此步中注意:不要吸取任何中间层物质,宁缺勿烂。)
6.12000rpm,4℃离心15min。
7.小心移去上清液,防止RNA沉淀丢失。
8.用70%乙醇(DEPC处理的水配制)洗涤1次,加入700μl乙醇,将RNA沉淀弹起,漂洗。(此时RNA是不溶解的)
9.8000rpm,室温离心10min。
10.尽可能彻底地吸走上清,防止RNA沉淀丢失。
11.真空离心干燥3—5分钟,或放在室温下使乙醇完全挥发掉。
12.沉淀用30μl DEPC-H2O溶解。如发现沉淀难溶,68℃处理10min。
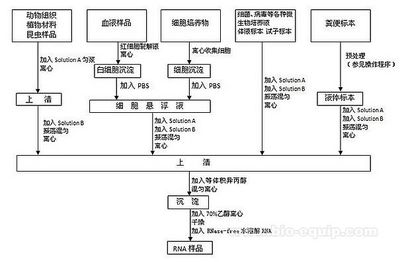
13.RNA检测
(1)测定样品在260nm和280nm的吸光值按1OD=40μg/ml RNA计算RNA的产量。
OD260/OD280在1.8-2.0。
(2)进行甲醛变性琼脂糖凝胶电泳,确定RNA的完整性和污染情况。
注意事项:
1.获得RNA效率低有一下原因
a:样品裂解或匀浆处理不彻底
b:最后得到地RNA沉淀未完全溶解
2.A260/A280<1.65原因
a:检测吸光度时,RNA样品不是溶于TE,而是溶于水。低离子浓度和低PH条件下,A280值会较高
b:样品匀浆时加地试剂量太少
c:匀浆后样品未在室温放置2分钟
d:水相中混有有机相
e:最后得到地RNA沉淀未完全溶解
3.RNA降解原因
a:组织取出后没有马上处理或冷冻
b:样品或提取地RNA沉淀保存于-5--20度,未在-60--70度保存
c:细胞在胰酶处理时被破坏
d:溶液或离心管未经RBase去处理
 爱华网
爱华网