第十二章 缓释与控释制剂
2分左右
内容
基本要求 | 1.缓释控释制剂特点 | (1)缓释制剂的特点 |
2.口服缓释、控释制剂的处方设计 | (1)影响口服缓释、控释制剂设计的因素 | |
缓(控)释制剂的释药原理及方法 | 1.溶出 | 减小药物溶出速度的方法 |
2.扩散 | 减慢药物扩散速度的方法 | |
3.其它 | (1)溶蚀与扩散、溶出相结合 |
缓释、控释制剂的处方和制备工艺 | 1.骨架型缓释、控释制剂 | (1)骨架片的分类、特点与骨架材料 |
2.膜控型缓释、控释制剂 | (1)微孔膜包衣片的衣膜材料和致孔剂 | |
3.渗透泵型控释制剂 | 组成、分类、常用材料 | |
缓释、控释制剂的体内外评价方法 | 1.体外释放度试验 | (1)释放介质 |
2.体内外相关性 | 相关性意义及相关情况 |
考点摘要
第一节 概述
一、定义
控缓释制剂:通过适当的方法,延缓药物在体内的释放、吸收、分布、代谢和排泄的过程,从而达到延长药物作用的一类制剂。
缓释制剂:按照要求缓慢非恒速地释放药物。
控释制剂:药物从控释系统释放的速度在一定时间内不随时间的推移而变化。
二、特点
1.对半衰期短或需频繁给药的药物,可以减少服药次数,提高病人顺应性,使用方便。
2.使血液浓度平稳,避免峰谷现象,有利于降低药物的毒副作用。
3.减少用药的总剂量,因此可用最小剂量达到最大药效。
4.缺点:缓(控)释制剂的设计基于健康人群的药物动力学数据,临床上难以灵活调节给药方案;产品成本较高,价格较贵。
三、缓(控)释制剂的处方设计
(一)影响口服缓释、控释制剂设计的因素
1.药物的理化因素:剂量、pKa、解离度和水溶性、油-水分配系数、稳定性
(1)剂量大小:常规口服制剂的单剂量最大剂量一般是0.5~1.0g,同样适用于缓(控)释制剂。
(2)pKa、解离度和水溶性:一般非解离型的、脂溶性大的药物易通过脂溶性生物膜,胃肠道PH和药物的Pka会影响药物的解离程度。溶解度很小的药物﹙<0.01mg/ml﹚,本身已具有内在的缓释作用。设计缓(控)释制剂对药物溶解度的要求文献报道下限为0.1mg/ml。
(3)药物的油、水分配系数:分配系数高的药物脂溶性大,通常能在体内滞留较长时间。分配系数小药物透膜困难,通常生物利用度较差。
(4)稳定性
2.生物因素:生物半衰期、吸收、代谢
(1)生物半衰期:一般t1/2短于1小时的药物制成缓(控)释制剂较为困难;t1/2很长的药物(t1/2﹥24h),一般也不采用缓(控)释制剂吸收。
(2)吸收:大多数药物及其制剂在胃肠道的运行时间为8~12小时,如药物释放过慢,会使药物的生物利用度降低。本身吸收速度常数很低的药物,不太适宜制备缓(控)释制剂。如药物通过主动转运吸收,或局限于小肠的某一特定部位吸收,则制成缓(控)释制剂不利于药物的吸收。
(3)代谢:在肠道内吸收前有代谢作用的药物,制成缓(控)释制剂时,生物利用度会有所降低。肠壁对药物代谢有饱和性,少量药物持续缓慢的释放到这个部位,酶会使较多量的药物代谢,药物能与特定的酶抑制剂共同制成缓(控)释制剂,可使药物吸收量增加,同时延长其治疗作用。
(二)缓释、控释制剂的设计
1.药物选择
(1)t1/2=2~8h 适宜;12h<t1/2或t1/2<1h,不适宜制成该类制剂。
(2)剂量很大、药效很激烈、溶解吸收很差、剂量需精密调节的药物不宜制成缓释、控释制剂。
2.设计要求
(1)生物利用度:与相应的普通制剂生物等效,即缓控制剂的相对生物利用度应为普通制剂的80~120%。
(2)峰谷浓度比:稳定时,峰、谷浓度应小于或等于普通制剂。
3.缓释、控释制剂的剂量计算
一般可根据经验,参考该药物普通制剂的剂量换算。(如:某普通制剂每日三次,每次100mg,若制成每日一次的缓控释制剂,一次剂量可为300mg。也可采用药物动力学的方法计算。)
4.缓(控)释制剂的辅料:阻滞剂、骨架材料、增黏剂
1)阻滞剂
①疏水物质:脂肪、蜂蜡、巴西棕榈蜡、氢化植物油、硬脂醇等可延滞水溶性药物的溶解,释放,主要作溶蚀性骨架材料。也可作缓释包衣材料。
②肠衣材料:CAP、EudragitL、S 型、HPMCP、HPMCAS(醋酸羟丙甲纤维素琥珀酸酯)
2)骨架材料:
①亲水性骨架材料:MC、CMC-Na、HPMC、PVP、卡波普、海藻酸盐、壳聚糖等。
②不溶性骨架材料:EC、聚甲基丙烯酸酯、聚氯乙烯、聚乙烯、EVA、硅橡胶等。
③溶蚀性骨架材料:同阻滞剂。
3)增黏剂:CMC-Na、PVA、PVP。
第二节 缓(控)释制剂的释药原理及方法
一、溶出原理:
溶出速度慢的药物显示出缓释的性质
根据Noyes-Whitney溶出速度公式
dC/dt=DS(Cs-C)/Vh
D为扩散系数
S为药物粒子的表面积
Cs为药物溶解度
C为溶出介质中药物浓度
V为溶出介质体积
h为扩散厚度
dC/dt=DS(Cs-C)/Vh
1.制成溶解度小的盐或酯——Cs减小;
2.与高分子化合物生成难溶性盐——Cs减小;
3.控制粒子大小,药物微粒粒径大,溶出慢,反之则快——S减小;
4.药物包藏于溶蚀性骨架中,释放速度受基质溶蚀速度控制;
5.将药物包藏于亲水性高分子材料中:吸水膨胀—凝胶屏障—药物通过屏障层—扩散到表面—溶于体液中。
二、扩散原理
(一)水不溶性材料包衣的制剂
(二)包衣膜中含有部分水溶性聚合物
如乙基纤维素与甲基纤维素混合组成的膜材,还受膜孔直径、孔道的弯曲因素和孔隙率大小影响
(三)水不溶性骨架片:通过骨架中弯弯曲曲的孔道进行扩散释放
骨架型是药物均匀分散在聚合物骨架中,药物在外层溶液中溶解,然后扩散出骨架,使固体药物不断溶出
此种骨架片中药物释放是通过骨架中许多弯弯曲曲的孔道扩散进行的
1.包衣
2.制成不溶性骨架片剂——水溶性药物
3.增加粘度以减少扩散速度:主要用于注射剂或其他液体制剂
4.制成微囊
5.制成植入剂
6.制成乳剂
三、溶蚀与扩散、溶出结合
释药系统决大多数取决于溶出或扩散,但某些骨架型制剂,骨架本身也处于溶蚀的过程,结果使药物扩散的路径长度改变,形成移动界面扩散系统。
此类系统的优点在于材料的生物溶蚀性能不会最后形成空骨架,缺点则是由于影响因素多,其释药动力学较难控制。
四、渗透泵原理
五、离子交换作用
带电荷的药物可结合于树脂上。当带有适当电荷的离子与离子交换基团接触时,通过交换可将药物游离释放出来。
树脂+-药物-+ X-→树脂+-X-+ 药物-
或 树脂--药物++ Y+→树脂--Y++药物+
X-和Y+为消化道中的离子,交换后,游离的药物从树脂中扩散出来。
药物在树脂中的扩散速率受扩散面积、扩散路径长度和树脂的刚性的控制。
第三节 缓释、控释制剂的处方和制备工艺
一、骨架型缓释、控释制剂
(一)骨架片的分类、特点与骨架材料
1.不溶性骨架片,如:聚乙烯、聚氯乙烯、EC 、甲基丙烯酸-丙烯酸甲酯共聚物等。
2.生物溶蚀性骨架片,如:巴西棕榈蜡、硬脂酸、硬脂醇、单硬脂酸甘油酯(蜡、脂)
3.亲水凝胶骨架片,水溶性药物主要以药物通过凝胶层的扩散为主;难溶性药物则以凝胶层的逐步溶蚀为主。凝胶完全溶解,药物全部释放。
(二)缓释、控释颗粒(微囊)压制片
方法1:几种释药速度不同的颗粒混合压片
方法2:微囊压片
方法3:药物制成小丸,再压片
(三)胃内滞留片
指能滞留胃液内,延长药物在消化道的时间,改善药物的吸收。
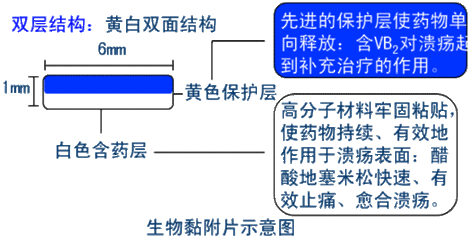
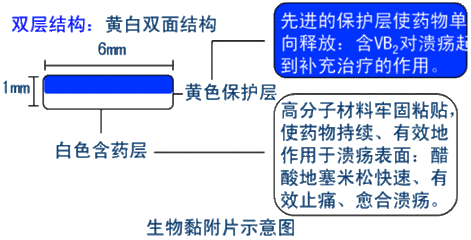
(四)生物黏附片
可黏附于生物黏膜,缓慢释放药物并由黏膜吸收达到治疗目的。
意口贴
保护创口,减轻疼痛,避免感染。
快速愈合
(五)骨架小丸
二、膜控型缓释、控释制剂
(一)微孔膜包衣片的衣膜材料和致孔剂
微孔膜控释剂型通常是用胃肠道中不溶解的聚合物如醋酸纤维素、乙基纤维素、乙烯-醋酸乙烯共聚物、聚丙烯酸树脂等作为衣膜材料,在其包衣液中加入少量水溶性物质(如PEG、PVP、PVA、十二烷基硫酸钠、糖和盐等)作为致孔剂。
(二)膜控释小片、肠溶控释小片、膜控释小丸
膜控释小片:其直径约为3mm,用缓释膜包衣后装入硬胶囊使用。在同一胶囊内的小片可包上具不同缓释作用的包衣或不同厚度的包衣。
三、渗透泵型控释制剂
渗透泵片由药物、半透膜材料、渗透压活性物质和推动剂等组成。
常用半透膜材料:醋酸纤维素、乙基纤维素等。
常用渗透压活性物质:当药物本身的渗透压较小时,加人这些渗透压活性物质用来产生较高的渗透压,作为释放的动力,氯化钠、乳糖、果糖、葡萄糖、甘露醇的不同混合物。
多层或多室渗透泵控释制剂,需要推动作用更大,常用:聚羟甲基丙烯酸烷基酯、PVP、聚氧乙烯等——推动剂
【例题】
A.醋酸纤维素
B.乙醇
C.聚氧乙烯
D.氯化钠
E.1.5%CMC-Na溶液
渗透泵型控释制剂常用的半透膜材料
【答案】A
渗透泵型控释制剂的推动剂
【答案】C
渗透泵型控释制剂的渗透压活性物质
【答案】D
总结:
缓(控)释制剂的释药原理及方法
一、溶出原理
二、扩散原理
三、溶蚀与扩散、溶出结合
四、渗透泵原理
五、离子交换作用
一、溶出原理:
1.制成溶解度小的盐或酯;
2.与高分子化合物生成难溶性盐;
3.控制粒子大小;
4.药物包藏于溶蚀性骨架中;
5.将药物包藏于亲水性高分子材料中。
二、扩散原理
1.包衣
2.制成微囊
3.制成不溶性骨架片剂
4.增加粘度以减少扩散速度
5.制成植入剂
6.制成乳剂
骨架型缓释、控释制剂
(一)骨架片:不溶性骨架片、生物溶蚀性骨架片、亲水凝胶骨架片
(二)缓释、控释颗粒(微囊)压制片
(三)胃内滞留片
(四)生物黏附片
利用扩散原理达到缓(控)释作用的方法是( )
A.制成溶解度小的盐或酯
B.与高分子化合物生成难溶性盐
C.包衣
D.控制粒子大小
E.将药物包藏于溶蚀性骨架中
【答案】C
渗透泵型片剂控释的基本原理是
A.减小溶出
B.减慢扩散
C.片外渗透压大于片内,将片内药物压出
D.片剂膜内渗透压大于片剂膜外,将药物从细孔压出
E.片剂外面包控释膜,使药物恒速释出
【答案】D
缓、控释制剂不包括下列哪种
A.分散片
B.胃内漂浮片
C.渗透泵片
D.骨架片
E.植入剂
【答案】A
第四节 缓释、控释制剂的体外评价方法
一、体外释放度实验
1.仪器装置:溶出 度测定仪
2.温度:37℃±0.5℃
3.释放试验的介质
去空气的新鲜纯化水(非蒸馏水)或0.001~0.1mol/l 稀盐酸或PH3~8的磷酸盐缓冲液
4.取点设计与释放标准
释药全过程的时间不应低于给药的间隔时间,且累积释放百分率要求达到90%以上。
5.药物释放曲线的拟合
对于缓释制剂,常用一级释药方程、Higuchi 方程进行拟合;
对于控释制剂,常用的模型有零级释药方程。
至少应测三个取样点
第一取样点:0.5~2h,主要考察有无突释效应;
第二取样点:中间点,用于确定释药特性;
第三取样点:最后取样点,考察释药是否完全;
第四、五点:控释制剂。
二、体内外相关性
缓(控)释制剂要求进行体内外相关性试验,它应反映整个体外释放曲线与血药浓度-时间曲线之间的关系。只有当体内外具有相关性,才能通过体外释放曲线预测体内情况,即用体外溶出或释放试验结果作为制剂产品体内生物利用度特性的指示。
1.点点相关关系:是最高水平的相关关系,体外释放曲线与体内吸收曲线上对应的各个时间点分别相关。(表明两条曲线可以重合)
2.应用统计矩分析原理建立体外释放的平均时间与体内平均滞留时间之间的相关:由于能产生相似的平均滞留时间可有很多不同的体内曲线,体内平均滞留时间不能代表体内完整的血药浓度-时间曲线。
3.单点相关关系:只能说明部分相关。
例:制定缓、控释制剂释放度时,至少应测定几个取样点
A.1个
B.2个
C.3个
D.4个
E.5个
【答案】C
例:关于体内外相关性的叙述,错误的是
A.体外释放曲线与体内吸收曲线上对应的各个时间点分别相关,是点对点相关
B.点对点相关是最高水平的相关关系
C.某个时间点的释放量与药动学参数之间的单点相关只能说明体内外有部分相关
D.单点相关是最高水平的相关关系
E.体内体外相关时能通过体外释放曲线预测体内情况
【答案】D
 爱华网
爱华网