经常有患者或医生们咨询G显带(实际上说的是染色体核型分析)、FISH(荧光原位杂交)和PCR技术(基因检测)在慢性粒细胞白血病(CML)检测中各有什么长处和劣势?故在此予以介绍,希望大家容易看得明白。本文内容将不仅适合于CML的检测,也适合于很多其它血液、非血液肿瘤及遗传病或先天疾病的检测。
首先,来个看图说话。
下面的图显示了正常情况下,每个体细胞内可以通过染色体核型分析看到的46条染色体。这46条染色体又可以分为2对。图中像毛毛虫一样有些模糊的、成对显示的,便是显微镜下看到的染色后的染色体的形状,右侧的是染出的不同深浅颜色的模拟图。
你似乎很难从两条毛毛虫中对应出右侧模拟图中的清晰的条带来,我也看不清楚。但我们经过培养的染色体的专业人员就有这样的火眼金睛。
别小看这46条毛毛虫,它们记载了编码你生命的信息。如果说生命是一本书,你可以把每条染色体看作为一个章节。这本书是由30亿个字(生物学上叫做“碱基”)写成的,可是比任何一本小说都长多了。这30亿个碱基并不是都编码基因的,其中只有约1~2%的碱基编码了约2万个不同的基因。
因为每条染色体有两份,看来上帝还是很眷顾我们的,将这本生命之书给了我们两个Copy。也就是说你从图中看到的这些毛毛虫实际上是由共60亿个基因的最小单元组成的,在46条毛毛虫中共分布了约4万个基因。
下面这幅图大概显示了从基因序列到染色体是一个什么样的级别的跨越。事实上,我们虽然能从显微镜下看到染色体的形状,但远远无法直接看到基因的序列,甚至每个基因在染色体上的具体位置也只能知道个大概。
下面开始介绍肿瘤发生基因变异的规律、特点和检测技术:
1.目前已知肿瘤发生的根源都是由于基因异常引起的,特定的异常可以导致特定类型的肿瘤,如BCR-ABL1融合基因的形成可以导致CML。
2.基因异常可以有多种形式: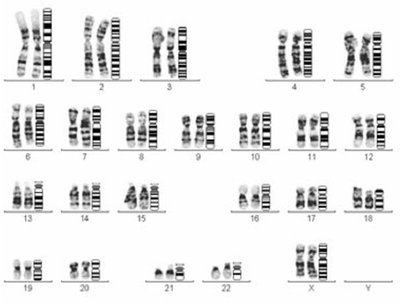
a)染色体数目异常:在肿瘤和先天病中,细胞内染色体的总数或每一编号的染色体的数目都可能异常。如大家可能听说比较的21三体可以导致先天愚型。在肿瘤患者中,也很常见染色体数目的异常。
b)染色体结构异常:在肿瘤患者中,还经常发现染色体的断裂、不同来源的染色体断裂后发生了错误的拼接(易位)、整条或者部分染色体的丢失。
由于基因是散布在染色体上的,所以染色体的断裂并不一定都伴有基因的断裂。实际上在所有发生过的断裂中,断裂位点位于基因上的只是少数。我们也常常在不同的患者中看到很多不同的、随机出现的染色体的断裂和重新拼接。
因此很多断裂和重新拼接是随机出现的,它们也有一定的意义,这些异常同时出现的越多,说明患者的基因在剧烈的发生变异,也就有更多的机会出现有意义的基因的异常。
c)融合基因的形成:有时候染色体断裂分布发生于两个不同的基因上,然后又相互拼接起来。这样就形成了新的异常的基因,如BCR-ABL1融合基因。由于这些异常的基因往往有特别的功能,因此常常和特定表现的疾病伴随出现。
下图左边显示了第9号和第22号染色体断裂并重新拼接形成Ph染色体和BCR-ABL1融合基因的示意图,右边显示了在显微镜下实际能看到的Ph染色体的样子。
白血病中还有很多类似情况形成的不同的融合基因,大多数融合基因都能够染色体形状的显著变异,因此可以通过染色体核型分析进行判断。但有少数情况时,第9号染色体ABL基因或第22号染色体BCR基因所在的染色体发生了非常微小的片段的缺失,并插入到另一个位置。这时候从染色体形态上就很难判断了。
还有少数融合基因是由于细微的染色体异常形成的,这时候就没有办法通过染色体核型分析来看出来了。如FIP1L1-PDGFRA融合基因,是由于第4号染色体上缺失了大约4千个碱基。4千听起来不小,但整条4号染色体是由上亿个碱基排列而成的宏观结构。因此想从染色体的形态区分4千个碱基的差别就不可能了。
这种情况下,如果还想从显微镜下来发现是否存在这些基因异常,就需要用荧光原位杂交(FISH)技术了。FISH是通过根据已知的基因序列合成探针,并分别标上不同的荧光。这个探针就可以根据基因的序列去寻找它在染色体上的位置,并与之结合。由于每条探针上标记很多个荧光分子,在荧光显微镜下就可以看到明亮的信号。如果两个基因分别标上红色和绿色荧光,如果两个基因跑到一起去了(形成了融合基因),红色和绿色荧光跑到一起,就变成了黄色的荧光(即融合信号)。
因此,要做常规的FISH检测,需要先确定检测的目的,选择不同基因的探针,并且只能对特定的基因进行分析。
d)基因组微小片段的缺失或点突变:肿瘤基因组中还可能存在很多微小的缺失或仅仅是一个碱基的突变。我们也常常可以看到一些白血病患者的染色体看起来是正常的,但虽然看起来正常,实际上它的基因组序列也可能已经千疮百孔了。这些异常方式也可能有很多种,一旦发生在关键的基因上,也会导致肿瘤的发生。
如NPM1基因的突变大多是由于某一确定位置多了4个碱基导致的,就可以导致急性白血病的发生。而JAK2V617F突变是仅仅由于一个位点的变化,就导致了慢性骨髓增殖性疾病的发生。
由于这些特点序列的变化非常细微,既无法通过染色体核型分析看到,也无法用FISH探针来检测。因此对于这些变异,就需要用PCR技术对特定的序列进行分析。
3.肿瘤发生和发展的一般规律。随着基因组研究的进展,人们对肿瘤基因变异的认识越来越深入,大概有以下几方面通用的规律:
a)肿瘤基因变异(或统称突变)的发生是一个累积的和概率的过程,有点类似于买彩票抽奖。不过这个奖是我们都不想得到的炸弹,得到反而是一种悲哀。我们每个人体内都在发生着突变,所以不管你是否希望,你时刻都在参与着这个抽奖,不过中大奖的概率非常低。
实际上大多数突变是无意义的,并不能导致肿瘤,像是没中奖的彩票;少数突变是小奖,最发病有辅助作用;对肿瘤发生有决定性作用的那就是大奖,也是最少的。因为没中奖的彩票和小奖的彩票被直接扔掉或忽略掉了,我们总喜欢强调大奖,所以我们常常研究和听说的都是对肿瘤发生有决定性意义或重要意义的突变。
对于肿瘤患者来说,有时是因为特别的不幸运而一举中大奖了。有些是因为抽奖次数过多(环境等因素导致体内突变率增加)而中了大奖。显然,抽奖的次数越多越容易中大奖,而且重到中奖或小奖的机会也比较多。
b)因此,一个肿瘤患者基因组内可能有很多变异,可以表现为不同的形式。有的是决定意义的,比如BCR-ABL1融合基因;有的也有一定的辅助意义,如复杂的染色体异常或特定的基因变异。
c)不仅肿瘤的发生是一个动态过程,肿瘤发生后它的基因组也在持续的发生着动态的变化。一旦出现了新的有意义的突变,还会导致疾病的进展。如部分CML患者发病时只能看到和检测到BCR-ABL1融合基因,但发生急变时就能看到复杂的染色体异常或IKZF1基因的变化。实际上是由于后来发生了更多的基因的异常,才导致了CML进展为急性白血病。
总结和答案:
知道了上面的知识,再来分析染色体核型分析、FISH和PCR检测基因这三种不同检测方式在CML检测中的不同应用和意义:
1.染色体核型分析:
a)已知CML患者有典型的Ph染色体易位,可以通过核型分析检测,但少数(约5%)的患者为细微的染色体易位,核型分析就不能检测出来,这时需要通过FISH或PCR检测。
b)染色体核型分析可以从宏观上分析患者其它可见的染色体异常情况,如伴复杂异常核型的患者预后较差一些。还可以分析BCR-ABL1融合基因的扩增。
c)对那些毛毛虫样图像的分析是技术性非常强、并且非常耗费人力的工作。因此大多报告仅对20个细胞的染色体核型进行分析,一般最多分析的细胞数不超过50个。
2.FISH检测:
a)一般的FISH检测需要指定基因特异性的探针,相对于染色体核型分析来说,可以更精确和更精细地对基因进行定位分析,但失去了核型分析的宏观性。
b)FISH对基因或融合基因的扩增也能较好地检测。
c)FISH检测一般最多和分析1000个细胞的荧光信号,检测灵敏度较核型分析高。
3.PCR扩增检测特定的基因序列:
a)BCR-ABL1融合基因虽然从核型分析上都是Ph染色体,看起来一样。但BCR-ABL1基因序列也有多种,而且从基因序列水平来看有很大差异。但BCR-ABL1融合基因的序列相对固定并有其规律,我们已经熟知了常见型BCR-ABL1融合基因的序列,因此可以根据基因序列设计相应的方案进行检测。
b)它的优势有:可以对多至百万个细胞进行检测,甚至发现一百万个细胞里的一个肿瘤细胞。是目前检测灵敏度最高的方法,适合进行微量肿瘤细胞残留的检测。不需要细胞培养或杂交过程,报告速度快。
c)但特定的基因检测方案,只能对特定的基因异常进行检测。如果只对初治或复发的CML患者进行BCR-ABL1的检测,只能知道BCR-ABL1融合基因的信息,而不能知到是否有其它附加的染色体异常,而后者是有一定预后意义的。
因此尤其对于初治或复发的CML患者,PCR检测并不能代替核型分析。
d)由于PCR方法只能检测很小范围内的基因序列,如果基因序列发生变异,可能会导致PCR检测的失败。
比如我们就发现大约5%的BCR-ABL1融合基因不是常见的序列,这种情况下虽然染色体核型分析和FISH方法往往能检测到Ph染色体或BCR-ABL1融合基因。但会导致常规BCR-ABL1PCR方法检测的失败,从而导致假阴性,需要对患者进行特别的分析,才能确定其特定的BCR-ABL1融合基因的序列。对于PML-RARA融合基因我们也发现类似的情况。
因此PCR方案也不嫩作为完全的依赖,当临床情况和实验室检测不符时,应结合更多的检测结果分析,并考虑到技术上限制导致的假阴性的可能性。必要时,对特点的标本做进一步的分析。。
因此,上述三种分子生物学检测方法各有优缺点,并不能完全相互替代。尤其在一些复杂或少见情况时,临床医师和实验室人员应熟知各自的特点,才能把它们用好。
 爱华网
爱华网