【课题】用过氧化氢制备环己酮
一.教材内容
选自:有机化学实验 章节:第三章有机化合物的制备实验
二.教学设计背景与定位
课型:本课题通过讨论和实验操作相结合的方法进行科学探究式学习
教学时教:课堂45分钟完成实验前讲解,剩余三课时学生自主通过实验完成学习
三.教学目标;
1.知识与技能:⑴学习并掌握绿色制备环己酮的原理和方法
⑵掌握巩固萃取,洗涤,干燥,蒸馏等基本操作
2.过程与方法:⑴课堂中,教师组织,引导和点拨,学生通过实验和讨论交流进一步认识有机氧化反应的本质,内涵
⑵学生通过了解物质的相关物性常数以及反应原理,选择合适的实验方法
⑶学生学会用给予的信息,通过对其加工,获取核心内容。使学生逐步形成良好的科学探究习惯与方法
3.情感态度与价值观:⑴通过探究实验:培养学生合作交流以及勤于思考,勇于创新实践。严谨求实的科学精神
⑵通过探究实验:培养学生对知识进行抽象概括的认知能力
⑶通过探究实验:培养学生设计实验的能力,在实验中发现问题,分析问题,解决问题的能力
四.教学重难点:
重点:实验相关操作解释,包括生成环己酮的反应原理,实验选择用过氧化氢制备的原因以及对萃取,洗涤,干燥,蒸馏等基本操作的回顾
难点:相关反应的原理讲解以及实验注意事项的部分细节
五.学生特征分析:
1.在之前的有机化学学习中,学生通过学习,对环己醇氧化生成环己酮有了一定的了解,但对本课题环己酮的制备操作没有深入的认识。
2.通过之前的探究实验,在科学探究实验活动中教师的指导下,学生可以自主地进行实验
3.通过之前的探究实验,在科学探究实验活动中教师的知道些,学生可以自主地进行实验
六.教学准备与相关资源利用:
1.教师参考书目:《有机化学实验》(南京大学出版社第二版)
《有机化学实验》(化学工业出版社)
2.教师准备:板书设计,相关数据以及知识拓展的查阅
3.实验用具:三颈烧瓶(250ml)、滴液漏斗、球形冷凝管、蒸馏头、接液管、分液漏斗、温度计、普通玻璃仪器、电热套
环己醇、氯化铁试剂、过氧化氢、氯化钠、无水碳酸钠
七.教学过程
教师活动 | 学生活动 | 设计意图 | |
创设情境,引出课题 | 环己酮为无色透明液体,带有泥土气息味,是重要的有机化工原料。广泛应用于纤维、合成橡胶、工业涂料、医药等工业。也是合成己二酸等化合物的主要中间体。今天我们就一同探究制备环己酮的方法。在这一过程中,请大家明确它的原理,同时重点回顾我们之前学过的回流装置以及蒸馏,萃取等基本操作。 | 聆听,了解环己酮的主要用途,明确实验目的的同时对环己酮的制备产生兴趣。 | 激发学生兴趣,倒入过程中指出实验目的与重点,让学生明确任务,对教师在相关问题讲解上提出自己的问题 |
实验原理讲解 | 下面我们来讲一下实验原理。实验室中合成环己酮常用的方法是环己酮作原料,漂白粉(NaClO)作氧化剂,在弱酸性条件下完成(方法二),也可用铬酸氧化剂来制备环己酮(方法一)。为了克服采用铬酸法存在环境污染的缺点,我们研究以30﹪过氧化氢为氧化剂,用价廉易得、水溶性好(920 g/L (20℃))、无毒无害、易分离回收的氯化铁为催化剂,催化氧化环己醇得到环己酮。 | 聆听,思考。用过氧化氢法制环己酮具体有哪些优点? 学生答。 老师最后总结:反应条件温和,容易控制,产物只剩下水,无毒害废弃物产生,反应时间短,反应产物也极易分离。 | 引导学生在今后自主设计实验时,反应物一方面要选取反应速率较快的,另一方面更要绿色化学,实用性以及在操作中的方便性考虑在内。 |
实验原理讲解 | 用环己醇反应制环己酮是一个氧化反应。反应方程式是环己醇与过氧化氢反应生成环己酮和水。总的反应实质是双氧水在催化剂作用下生成OH自由基,OH自由基与环己醇反应生成环己酮。由环己醇制备环己酮的反应大家应该不陌生,书上的反应是用硝酸,五氧化二钒加热氧化制得。 | 学生回忆有机化学理论课上学过的内容,加深印象。 | |
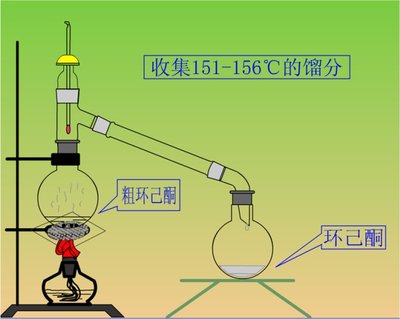
实验仪器,药品,装置讲解。 | 下面我们来讲一下实验仪器,药品和装置。 仪器和药品都列在黑板上了,相信你们在写预习报告时已经有所了解。我们这次实验要搭两个装置,一个是回流装置一个是蒸馏装置。回流装置在我们制备己二酸时也已用到,三角烧瓶分别插恒压滴液漏斗,温度计和回流冷凝管。大家应该也有印象。蒸馏装置就更不用说了。 | 熟悉实验仪器,药品和装置。回忆制备己二酸时所用到的装置 | 回顾已学知识,对重点部分再强调加深印象。 |
实验步骤 | 以上就是反应原理和实验装置分析,下面我们来看实验操作。 | ||
实验步骤 | 在250ml三颈烧瓶中加入10.5ml环己醇,2.5g氯化铁。用恒压滴液漏斗慢慢滴加3ml 30﹪过氧化氢(15-20min滴完)。水浴温度控制在55-60℃。过氧化氢滴加完后,继续反应30min,振荡使反应完全,可看到反应液呈墨绿色。 | 明确实验步骤 | |
实验步骤 | 反应完成后,将60ml水和几颗沸石于三颈烧瓶,改成蒸馏装置,这加水蒸馏产品实际上是一种简化了的水蒸气蒸馏,环己酮可与水形成恒沸混合物,可一起蒸出。至不再浑浊后再多蒸出15-20ml,收集约50ml馏出液。 | 让学生了解简化的水蒸气蒸馏。 | |
馏出液用精盐饱和,这一步就是盐析。大家知道盐析的作用是什么吗?盐析是指溶液中加入无机盐类而使物质溶解度降低而析出的过程。在这里盐析的目的就是降低环己酮的溶解度,有利于下一步的分层。 | 学生回忆并思考。之前在制备乙酸乙酯时讲过盐析的作用。 | 让学生明确盐析的目的 | |
而后转入分液漏斗,静置分出有机层在这里要注意几个问题。静置时间要充分,如果静置时间不够长,会导致环己酮的流失。因此为了使产量更高,水层再用15ml无水乙醚萃取。区分有机层和水层的方法老师在制备乙酸乙酯实验时讲到过,请同学回答。萃取的原理也要求学生回忆讲述。 | 学生回忆区分有机层和水层的方法并回答。 方法:用滴管取一滴蒸馏水滴入分液面处,进入下液面的下面就是水层,反之下面即为有机层。 萃取的原理也是学生该熟知的内容,继续让学生思考并作答。 萃取的原理是利用物质在两种不互溶的溶剂中溶解度来达到分离。环己酮在水中的溶解度为2.4g/ml,环己酮易溶于乙醚。 | 学生回顾已学基本知识,对重点部分再强调加深印象。 | |
实验步骤 | 而后合成有机层和萃取液,再用无水碳酸钠干燥,干燥的方法我们也再来回忆一下:如何干燥:分批少量多次;判断是否已经干燥好:干燥剂能在液体内自由滑动,液体清澈透明。最后水浴蒸馏除去乙醚,因为环己酮的沸点是155.65℃,所以收集150-160℃馏分,进行称量。在温度升高过程中一定要注意温度计示数的变化,当达到125℃时,要将直形冷凝管改为空气冷凝管。 | 一起回忆干燥的方法。 | 回忆物质干燥的方法。加深记忆 |
注意事项 | 最后我们来看一下注意事项。注意事项有两点:1.分液后的水层不能倒掉,在萃取时还会用到 2.反应温度不宜过高,温度太高会产生副反应,可用冷水浴适当冷却 3.过氧化氢有强氧化性,取用时要带手套,以免腐蚀手 4.当温度达到125℃时,要将直形冷凝管换成空气冷凝管 |
板书设计
用过氧化氢制备环己酮
一.实验目的:1)学习过氧化氢氧化法制备环己酮的原理和方法,掌握仲醇转变为酮的试验方法
2)巩固萃取,洗涤,干燥,蒸馏等基本操作
3)了解绿色氧化等合成方法
二.实验原理
实验室中合成环己酮常用的方法是环己酮作原料,漂白粉作氧化剂,在弱酸性条件下完成,也可用铬酸氧化剂来制备环己酮。但铬酸法存在环境污染总的反应实质是双氧水在催化剂作用下生成OH自由基,OH自由基与环己醇反应生成环己酮。
方程式:
副反应:环己酮氧化生成己二酸
1.过氧化氢做氧化剂
2.用价廉易得、水溶性好(920 g/L (20℃))、无毒无害、易分离回收的氯化铁为催化剂
3.温度控制在55-60℃之间
相关物性常数:环己醇: Mr=100.6b.p.=161.5℃溶解度:5.67g/ml
环己酮: Mr=98.14b.p=155.65℃溶解度:2.4g/ml
共沸物:环己酮(38﹪)-H20(62﹪)95℃
环己醇(20﹪)-H2O(80﹪) 98℃
三.仪器与药品
1.仪器:三颈烧瓶(250ml)、滴液漏斗、球形冷凝管、蒸馏头、接液管、分液漏斗、温度计、普通玻璃仪器、电热套
2.药品:环己醇、氯化铁试剂、过氧化氢、氯化钠、无水乙醚、无水碳酸钠
3.装置图: 空气冷凝管
四.实验步骤:
250ml三颈烧瓶→10.5ml环己醇,2.5g氯化铁→慢慢滴加3ml30﹪过氧化氢(滴液漏斗) 水浴55-60℃→继续反应30min→振荡使反应完全→反应液呈墨绿色
60ml水和几颗沸石于三颈烧瓶→改成蒸馏装置→环己酮和水一起蒸出→不再浑浊后再多蒸出15-20ml→收集50ml馏出液→盐析→转入分液漏斗→静置分出有机层→水层用15ml无水乙醚萃取→合成有机层和萃取液→用无水碳酸钠干燥→水浴蒸馏除去乙醚→收集150-160℃馏分,称量。
五.注意事项
1.分液后的水层不能倒掉,在萃取时还会用到
2.反应温度不宜过高,温度太高会产生副反应,可用冷水浴适当冷却
3.过氧化氢有强氧化性,取用时要带手套,以免腐蚀手
4.当温度达到125℃时,要将直形冷凝管换成空气冷凝管
教学反思
很感谢有机实验老师能够提供一个好的平台让我们在大二就有机会说课。这次我讲的是用过氧化氢制环己酮。通过教学,结合同学教学评价表的反馈,也有许多值得我学习与反思。
优点:1.教态自然,课堂表现力不错,语速适中
2.板书清晰,字体美观大方
3.思路条理清晰,讲解清楚
4.准备充分,联系所学知识,内容丰富,概念提问学生,注重师生互动
不足:1.讲解过程中出现口误,声音小
2.对相关步骤思考没有深入,导致学生提出的几个问题不知如何回答
具体有:1.恒沸混合物到底是什么意思?什么概念?
当两种或者三种液体以一定比例混合,可组成具有固定沸点的混合物,将这种混合物加热至沸腾时,在气液平衡体系中,气相组成和液相组成一样,故不能使用分馏法将其分离出来,只能按一定比例组成的混合物,即为恒沸混合物。
2.怎样辨别馏出液已有50ml?
将装有50ml水的与收集容器同等规格的三角烧瓶放在旁边作比较
3.在125℃要将直形冷凝管改成空气冷凝管,为什么不在一开始就用空气冷凝管?
刚开始馏出液温度低,空气冷凝管冷却不了,要用直形冷凝管要用水冷却
4.用无水碳酸钠干燥有什么好处?
碳酸钠不会吸附有机物,能与水形成结晶(Na2CO3.10H20)当然其他干燥剂有无水硫酸镁也可以。
因为对这次讲课准备比较充分,而且也是同班级的同学听,所以几乎没有感到紧张。很高兴自己能够跨出这一步,但以后真正的说课比赛,面试,上课肯定比现在难很多,需要一步步努力。在这学期末还会有机会再讲一次有机实验,也是我独立一人从实验目的讲到注意事项。希望下次研究步骤更细致。不会有回答不了的问题,我会努力的。
最后突然想到了一点,今天有个人的反馈表上写了提的问题太多,随后我又问了几个同学,他们觉得提的问题题数合适(恒压滴液漏斗滴的为什么是过氧化氢,而不是环己醇?盐析,萃取原理;怎样简易区分有机层与水层;干燥剂使用共5个问题)怎样才可以做到最好的师生互动,讲解一个实验时提几个问题最合适,怎样顾及到所有学生,也值得我深思。

 爱华网
爱华网