2、三个基本关系
(1)数量关系:质子数=核电荷数= 核外电子数(原子中)
(2)电性关系:
①原子中:质子数=核电荷数=核外电子数
②阳离子中:质子数>核外电子数或 质子数=核外电子数+电荷数
③阴离子中:质子数<核外电子数或 质子数=核外电子数-电荷数
(3)质量关系:质量数=质子数+ 中子数
[特别提醒] 对于公式:质量数(A)=质子数(Z)+中子数(N),无论原子还是离子,该公式均适应。 原子可用表示,质量数A写在原子的右上角,质子数Z写在原子的左下角,上下两数值的差值即为中子数。原子周围右上角以及右下角或上面均可出现标注,注意不同位置标注的含义,右上角为离子的电性和电荷数,写作n;右下角为微粒中所含X原子的个数,上面标注的是化合价,写作n形式,注意与电荷的标注进行正确区分,如由氧的一种同位素形成的过氧根离子,可写作O。 |
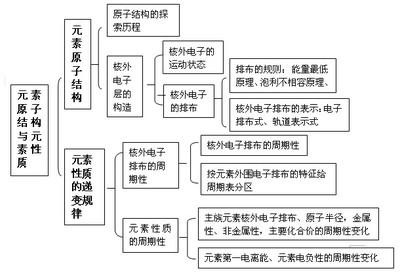
考点2 原子核外电子排布规律
核 外 电 子 排 布 规 律 | 1 | 各电子层最多能容纳 2n2 个电子 即:电子层序号 1 2 3 4567 代表符号K LM NOP Q 最多电子数 2 8 18 32 50 72 98 |
2 | 最外层电子数目不超过 8个(K层为最外层时不超过2个)。 | |
3 | 次外层电子数最多不超过 18 个,倒数第三层不超过 32 个。 | |
4 | 核外电子总是尽先排满能量最低、离核最近的电子层,然后才由里往外,依次排在能量较高,离核较远的电子层。 | |
注意 事项 | 1.以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。 2.上述乃核外电子排布的初步知识,只能解释1~18号元素的结构问题,若要解释更多问题,有待进一步学习核外电子排布所遵循的其它规律。 |
[特别提醒]1-18号元素的原子结构特性: ①原子核中无中子的原子:11H。 ②最外层有1个电子的元素:H、Li、Na。 ③最外层有2个电子的元素:Be、Mg、He。 ④最外层电子数等于次外层电子数的元素:Be、Ar。 ⑤最外层电子数是次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne。 ⑥电子层数与最外层电子数相等的元素:H、Be、Al。 ⑦电子总数为最外层电子数2倍的元素:Be。 ⑧次外层电子数是最外层电子数2倍的元素:Si。 ⑨内层电子数是最外层电子数2倍的元素:Li、P。 |
考点4微粒半径的大小比较和10电子、18电子微粒
1.原子半径和离子半径
原 子 半 径 | 1.电子层数相同时(同周期元素),随原子序数递增,原子半径减小 例:Na>Mg>Al>Si>P>S>Cl 2.最外层电子数相同时(同主族元素),随电子层数递增原子半径增大。 例:Li<Na<K<Rb<Cs |
离 子 半 径 | 1.同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。例:Cl―>Cl,Fe>Fe2+>Fe3+ 2.电子层结构相同的离子,核电荷数越大,半径越小。例:O2―>F―>Na+>Mg2+>Al3+ 3.带相同电荷的离子(同主族元素的离子),电子层越多,半径越大。 例:Li+<Na+<K+<Rb+<Cs+;O2―<S2―<Se2― 4.带电荷、电子层均不同的离子可选一种离子参照比较。 例:比较K+与Mg2+可选Na+或Ca2+为参照可知K+>Na+(或Ca2+)>Mg2+ |
2.10电子的微粒:
(1)分子: Ne、CH4、NH3、H2O、HF ;
(2)离子: Na+、Mg2+、Al3+、NH4+、NH2-、H3O+、OH-、O2-、F- 。
3.18电子的微粒:2.(1)
(1)分子: Ar、SiH4、PH3、H2S、HCl、CH3CH3、N2H4、H2O2、F2、CH3OH、CH3F 等;
(2)离子: S2-、Cl-、K+、Ca2+、HS- 。
[特别提醒]:
记忆10电子微粒的方法:首先找出10电子的原子(单原子分子)Ne,然后向前寻找非金属元素对应的氢化物:CH4~HF,向后寻找金属形成的阳离子:Na+~Al3+。在氢化物的基础上增加或减少H+,可构成一系列的离子。
记忆18电子的微粒方法:首先找出18电子的原子(单原子分子)Ar,然后向前寻找非金属元素对应的氢化物:SiH4~HCl,向后寻找金属形成的阳离子:K+~Ca2+。在氢化物的基础上减少H+,可构成一系列的离子。还有部分18电子的分子可通过10电子的氢化物分析得到,10电子的氢化物分子去掉一个H得到9电子的基团:—CH3、—NH2、—OH、—F,这些基团两两结合可形成18电子的分子。
![[转载]高考总复习——化学——原子结构与性质_Jackqvehicle](http://img.413yy.cn/images/01111101/01120630t01e6230eea22364db9.jpg)
热点2原子的核外电子排布
新课导练2
2-1.(2008·海珠区模拟)短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是()
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
[解析]根据题意,由“B原子的最外层电子数等于A原子的次外层电子数”可知,B原子的最外层电子数为2或8。若为2,因“A与C同主族”,则A、C的最外层电子数为4,故A、B、C依次为C、Mg、Si;若为8,则A、C的最外层电子数为1,故A、B、C依次为Na、Ar、K(非短周期元素,不满足题意)。故A、B、C依次为C、Mg、Si。
[答案]B D
2-2.(2008·汕头二模)元素X和Y在元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是()
A.X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
B.Y元素的单质不能和金属氧化物反应
C.X和Y构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素阳离子
D.X元素的一种单质能有效地吸收太阳光线中的紫外线
[解析]由题意知,假设X的质子数为X,Y的质子数为Y,则有:X+Y=21,Y-X=5解得:X=8,Y=13即X为Al,Y为O;故答案为B。
[答案]B
热点310电子和18电子的考查
[真题4](2007·全国II)用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是_______、B元素是_______、C元素是_______(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是__________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是__________。
(4)F是由两种元素组成的三原子分子,其分子式是_______,电子式是________。
(5)G分子中含有4个原子,其分子式是__________。
(6)H分子中含有8个原子,其分子式是__________。
[思路分析] 根据18电子微粒的书写规律,正确写出这些微粒,然后逐一排查,结合题目得到答案。
[解析]本题主要考查有关原子结构的相关问题。可联系元素周期表分析、提取规律来推断。18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,结合题目所给条件,不难确定所需答案。
[答案](1)K Cl S(2)HCl (3)F2(4)H2S
(5)H2O2(答PH3也可)(6)C2H6
 爱华网
爱华网