在过去的40年里的时间里,Lefkowitz和Kobilka等众多优秀科学家通过不断的努力,不断丰富着我们对G蛋白偶联受体的了解。
G蛋白偶联受体是人类基因组中最大的膜蛋白家族,约包含800~1000个成员,在视觉、嗅觉、味觉以及神经传递等人类各项生理代谢活动过程中发挥着重要的作用。
目前的处方药中,以G蛋白偶联受体为药物靶点的药物约占一半以上。长期以来的研究表明,肾上腺素等可扩散的细胞外激素具有重要作用,介导体内一系列生理、生化和代谢反应,调控血压和心率等。
很多激素不能穿透细胞膜,因此人们开始怀疑这些激素作用在细胞表面的成分上,称为接受物质(ReceptiveSubstance)。在20世纪60-70年代以前,人们对细胞是如何感知激素等可扩散化合物的信号以及这些信号是如何传递至细胞内部的机制存在很多争论,许多资深的科学家甚至怀疑细胞表面受体是否真的存在,也有人认为化合物直接作用的对象就是腺苷酸环化酶(AC)。
1968年到1971年间,Lefkowitz采用放射性标记的方法标记了糖皮质激素和肾上腺素,证明了受体独立于腺苷酸环化酶(AC)的存在(Lefkowitz,Roth et al. 1970; Lefkowitz, Roth et al. 1970; Lefkowitz, Roth etal. 1970; Lefkowitz and Haber1971)。通过逐步摸索受体分离的方法,Lefkowitz研究小组纯化了b2肾上腺素能受体(b2-adrenergicreceptor),并证明将其放回细胞中后有受体活性,从而最终使所有人都相信了受体的存在(Lefkowitz, Haber etal. 1972; Caron, Srinivasan et al. 1979; Cerione, Strulovici et al.1983; Cerione, Strulovici et al. 1983)。
图1:肾上腺素受体结构 (改自 Scientific Background on the Nobel Prize inChemistry 2012)
左侧未与肾上腺素结合的肾上腺素受体AR(蓝色)处于未被激活状态
上世纪80年代,b2肾上腺素能受体的蛋白被成功分离后,Lefkowitz实验室试图鉴定编码b2肾上腺素能受体的基因,在那时Kobilka加入了Lefkowitz的实验室。Kobilka成功克隆了编码仓鼠和人类b2肾上腺素能受体的基因,并发现b2肾上腺素能受体含有7个a螺旋,该结构与视网膜中负责感应光的视紫质(rhodopsin)的结构相类似,从而第一次将光能感应和激素感应的受体直接联系起来(Dixon,Kobilka et al. 1986; Kobilka, Dixon et al. 1987)。
Lefkowitz以及其研究小组认为b2肾上腺素能受体和视紫质蛋白同属于一个尚未发现的蛋白家族,该蛋白家族以7个a螺旋为标志,并可能大部分都可偶联G蛋白。这一推断很快得到Lefkowitz自己实验室和其他实验室克隆的一系列受体所证实,揭示了包括很多孤儿受体在内的800~1000个成员的GPCR信号转导超家族,从而改变了早期化学家们只能通过合成与天然荷尔蒙或神经传递素结构相类似的分子来制造G蛋白偶联受体药物的局面。
在纯化和克隆b2肾上腺素能受体的同时,Lefkowitz及其小组成员也对受体工作的原理展开研究。通过同位素标记的配体结合等实验,Lefkowitz提出配体-受体-效应器相互作用的三级复合物模型,阐明磷酸化,GRK和Arrestin介导的受体脱敏的机制,并于近年来发现了非G蛋白依赖的Arrestin介导的信号途径。
Kobilka在创建自己的实验室后,为进一步阐明GPCR的工作原理,独立奋斗了15年,找到了通过抗体结合和在受体细胞内第三环中插入溶菌酶,从而使大部分低丰度的扩散型配体的GPCR可以结晶的方法(Rosenbaum,Cherezov et al. 2007)。
进而,Kobilka于2011年解析了b2肾上腺素能受体与G蛋白三聚体复合物的晶体结构,第一次在原子分辨率阐明了GPCR参与信号转导的机制(Rasmussen,DeVree et al.2011)。Lefkowitz和Kobilka的工作从根本上改变了人类对GPCR受体和跨膜信号传递的认识,对现代药物设计的方式有重要影响。
图2:通过放射性标记G蛋白偶联受体图A:碘-125标记的ACTH与肾上腺抽提物的结合情况(改自Lefkowitz, Roth etal.,1970),洗脱体系中仅有碘-125标记的ACTH(左图)或为碘-125标记的ACTH、未标记的ACTH与肾上腺抽提物的结合情况
1标记并分离纯化扩散型配体(diffusive ligand)的GPCR
在Lefkowitz的工作之前,人们在1870就发现了对光敏感的视紫质(rhodopsin),并在1933年由GeorgeWald发现了视紫红质,获得了1967年的诺贝尔奖,但从没有人把感光系统与体内激素的生理作用联系起来。受体的理论也早在20世纪初由Langley和Hill提出并描述,并在1920~1970年这半个世纪得到充分发展,然而受体本身是什么物质依然是一团疑云,充满争论。
随着Sutherland在六十年代发现cAMP在激素响应中的重要作用,很多人也认为腺苷酸环化酶就是受体,以至于1971年Sutherland在诺贝尔奖的演讲中,还提到激素也可能就是作用在腺苷酸环化酶(AC)上,这已经是Lefkowitz证明受体和腺苷酸环化酶(AC)是分开的物质一年以后了。
图3:GPCR基因的克隆 图A:根据克隆所得的人类2AR基因序列得到的氨基酸序列以及跨膜区域(Kobilka, Dixon etal., 1987)。图B:随后Lefkowitz实验室克隆的GPCR。图C:继而Axel和Linda Buck克隆的嗅觉受体
Lefkowitz的科学生涯起源于上世纪60年代末,作为医生的Lefkowitz加入了NIH的医生研究实习计划,开始用同位素标记一些激素。1970年,Lefkowitz使用放射性碘-125标记促肾上腺皮质激素(ACTH),发现了与促肾上腺皮质激素具有一定亲和力的受体物质,而具有生物活性的未被碘-125标记的促肾上腺皮质素可以抑制碘-125标记促肾上腺皮质激素与受体的特异结合(Lefkowitz,Roth et al. 1970)。
根据这些实验结果,Lefkowitz使用促肾上腺皮质激素受体检测血浆中促肾上腺皮质激素受体的含量,建立了一套快速灵敏检测血浆中具有生物活性肽类激素的新方法(Lefkowitz,Roth et al.1970)。同年,Lefkowitz关于钙离子对促肾上腺皮质激素的激活作用的研究表明促肾上腺皮质激素受体存在,激素受体的结合与腺苷酸环化酶的激活是两个独立的过程(Lefkowitz,Roth et al. 1970)。
这些结果表明细胞的表面具有可与细胞外激素结合的受体,但那时依然存在着质疑,怀疑者认为促肾上腺皮质素和去甲肾上腺素所结合的受体很可能是腺苷酸环化酶。
Lefkowitz随后将他的研究转向到具有重大生理学意义的肾上腺素和去甲肾上腺素,尝试发现肾上腺素受体。1971年,Lefkowitz通过使用放射性H-3标记的去甲肾上腺素(norepinephrine),证明在狗心室心肌组织8,000g离心的微粒体(78,000 g microsomalfraction)中可能存在肾上腺素的受体(实验表明,与之前促肾上腺皮质激素与受体结合相类似,与去甲肾上腺素相类似的儿茶酚胺类物质可竞争性阻断去甲肾上腺素与受体的结合)(Lefkowitzand Haber 1971)。
1972年,Lefkowitz使用去污剂显著提高了b2肾上腺素能受体蛋白的可溶性,并在此基础上首次制作了亲和层析柱,将琼脂糖的侧链上人工加入一个长度为30-A的糖链,并通过该链将琼脂糖与去甲肾上腺素偶联(Lefkowitz,Haber et al.1972)。Lefkowitz等利用该层析柱成功部分纯化获得了b2肾上腺素的受体蛋白,从而建立了可广泛应用的纯化扩散型配体G蛋白偶联受体的方法。通过该方法纯化b2肾上腺素的受体蛋白纯度提高了约500~800倍(Lefkowitzand Haber, 1972)。
随着实验室不停的继续摸索,1979年Lefkowitz实验室再度改进了b2肾上腺素能受体蛋白的纯化方法,他们使用拮抗剂alprenolol偶联的琼脂糖作为介质制作亲和层析柱,建立了更加便捷有效的纯化方法,该方法适合大规模纯化受体蛋白(Caron,Srinivasan et al. 1979)。
几年后,他们把纯化后的可与肾上腺素结合的细胞表面蛋白导入不响应肾上腺素的细胞后,发现细胞的表现与具有肾上腺素受体的细胞一致(Cerione,Strulovici et al. 1983; Cerione, Strulovici et al.1983)。这项实验结果使人们真正相信了细胞表面受体的独立存在。
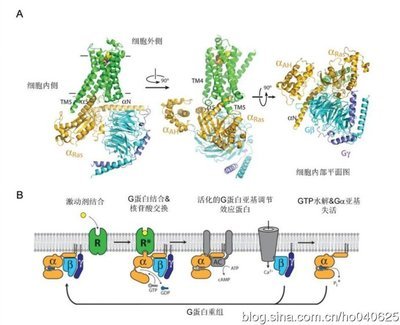
图4:配体-受体-效应器相互作用的三级复合物模型 (改自 Scientific Background on the NobelPrize in Chemistry 2012)
2肾上腺素受体(扩散型配体的GPCR)的基因克隆
能拿到纯化的肾上腺素受体蛋白,就可以通过测序获得部分蛋白的序列信息,为克隆肾上腺素受体的基因打开了大门。虽然1984年视紫质(Rhodopsin)的基因获得了克隆,但没有人将光感受体与可扩散的激素受体相关联起来,而激素受体表达的低丰度为工作带来了很大困难。
从1986年开始,当时在实验室做助理研究的Kobilka加入并领导了这项工作。起始的工作非常困难,用cDNA文库反复进行实验却得不到正确克隆。Kobilka于是大胆提出了使用基因组文库进行克隆。经过了组内热烈的讨论后,Lefkowitz同意了这一“疯狂”的研究方式。
1986年,Lefkowitz实验室首次成功克隆了编码仓鼠b2肾上腺素能受体蛋白(b2-adrenergic receptor,β2AR)的基因并进行了测序分析(Dixon, Kobilka et al.1986(注2))。对编码基因的序列的分析发现,b2AR与牛“光受体”视紫质蛋白(Rhodopsin)的氨基酸序列具有显著的相似性,二者都具有7次跨膜的区域(Dixonand kobilka et al., 1986,Nathans J and Hogness DS, 1984)。
Lefkowitz和Kobilka很快推断出Rhodopsin和b2AR可能属于同一家族,这一家族可能编码很多重要的激素受体。这一工作旋即被毒蕈硷乙酰胆碱受体(muscarinicacethylcholine receptor)的克隆所证实(Numa et al., 1986)。
基于这一推论,Lefkowitz实验室的Kobilka等人很快成功克隆了编码人类b2肾上腺素受体蛋白(b2AR)的cDNA,编码人类b1肾上腺素受体、人类血小板α2肾上腺素受体、5-羟色胺(5HTA1A)受体以及第一个孤儿受体(orphanreceptor)等在内的一系列受体的基因(Frielle, Collins et al. 1987; Kobilka, Dixonet al. 1987; Kobilka, Frielle et al. 1987; Kobilka, Matsui et al.1987; Fargin, Raymond et al. 1988)。
工作中得到的信息和技术也帮助了嗅觉受体(odorant receptor)这一超家族的发现和克隆(Linda and Axel,1991),该项成果荣获2004年诺贝尔生理学或医学奖。
图5:GPCR(7次跨膜受体)介导的信号转导和脱敏机制G蛋白和Arrestin两种不同的机制参与GPCR的信号转导。激动剂与受体结合,激动偶联于受体上的异源三聚体G蛋白。活化的G蛋白从受体上解离,并进一步激活经典的第
3GPCR工作机制研究
20世纪60年代Sutherland发现cAMP介导激素引起的细胞响应,于1971年获得诺贝尔奖,1986年Gilman分离纯化得到了G蛋白,并获得了1993年诺贝尔奖,这些都是GPCR信号转导的重要机制。除以上信号机制以外,Lefkowitz实验室和一些其他实验室也对GPCR的工作机制研究中做了重要贡献,包括提出并发展三元复合物模型,阐明受体磷酸化和脱敏机制,以及独立于G蛋白的b-抑制蛋白(b-arrestin)介导的信号转导系统等。
1)三元复合物模型的提出和发展
应用体外蛙红细胞中的beta2肾上腺素受体模型,Lefkowitz等观察到Gpp(NH)p,GTP,以及其他嘌呤核酸在不与受体结合的状态下降低受体的亲和力(Lefkowitz, Mullikin et al.1976)。
在此基础上,D-lean应用同位素标记的配体与受体的结合实验结果而提出“三元化合物”模型(Ternary complexmodel)。三元化合物模型包括激素H,受体R,与细胞膜成分X,而鸟苷酸可使三元化合物HRX中细胞膜成分X从受体R上解离出来,导致配体亲和能力的降低(DeLean, Stadel et al. 1980)。
实验室的Kent进一步通过计算机模拟系统收集Beta-肾上腺素受体与配体结合的信息,发现激动剂与受体之间有高亲和力和低亲和力两种不同的状态,而鸟苷酸可介导两种状态之间的转换,并且鸟苷酸的作用有剂量依赖性(Kent,De Lean et al. 1980)。
这一模型的提出在药理学工作中有广泛应用,既帮助了GPCR下游效应器的鉴定也帮助了发展高效亲和力的配体。该模型后来被实验室进一步发展为扩展型三级复合物模型;并在利用组成型激活突变体研究GPCR和GPCR的偏向性配体研究中得到广泛应用(Samama,Cotecchia et al. 1993)。
图6:扩散型配体的GPCR晶体结构解析图A:受体分段示意图(Kobilka, Kobilka et al.,1988),单独的AR 1-5跨膜区域SR (1-5)或6-7跨膜区域SR (6-7)因缺少AR活性而无法与特异配体结...
2)受体脱敏,磷酸化和其他后修饰
现代药物学发现受体的脱敏是重要的药理学现象。Lefkowitz实验室Mukherjee于1975年报道了持续激活蛙的肾上腺素受体可导致受体特异性脱敏(Mukherjee,Caron et al.1975)。受体脱敏表现在异丙肾上腺素激活腺苷酸环化酶最大效应下降25%,而1/2最大效应浓度并没有改变。
进一步的研究发现了b-肾上腺素受体脱敏的主要特点:1. 只有激动剂可导致受体脱敏的发生,而抑制剂能阻断激动剂与受体结合所致的脱敏;2.激动剂导致的b2肾上腺素能受体的灭活有时间和浓度依赖性(Mickey, Tate et al. 1975; Mukherjee andLefkowitz 1976)。
依据这些实验结论可推断受体脱敏并非由受体与配体亲和力降低所造成,而应该是受体数目和活力的影响。几年后,实验室的Stadel等证实了在脱敏的过程中存在受体结构变化(Stadel,Nambi et al. 1982)。
Stadel进一步应用[32P]同位素标记的磷酸盐预温育方法,得到磷酸化的b2肾上腺素能受体(Stadel, Nambi et al.1983)。在体外,重组的纯化的火鸡红细胞肾上腺素受体在ATP和cAMP依赖的蛋白激酶(PKA)的作用下也可达到磷酸化(Benovic,Pike et al. 1985)。
这一系列的实验揭示了磷酸化在受体脱敏过程中起到重要的调控作用。同年,Strulovici应用体外磷酸化的b2肾上腺素受体再植入受体缺失细胞,进一步证实受体磷酸化与重构系统中膜受体功能减退之间的直接联系(Strulovici,Cerione et al. 1984)。
1984年,Benovic从仓鼠肺脏中成功提取b2肾上腺素受体,通过高效液相胰蛋白酶肽色谱分析方法,明确阐明了受体中的两个磷酸化位点,证实PKA参与单个b2肾上腺素受体功能的调节(Benovic,Pike et al. 1985)。
继而,研究组提出了同源脱敏和异源脱敏的概念:同源脱敏是指脱敏受体对其特异性配体反应减弱,而其他受体的效能不受影响;异源脱敏是指当细胞暴露于一种激动剂时,可使多种受体介导的反应减弱(Strasserand Lefkowitz 1985)。
在证明磷酸化以及PKA在受体磷酸化和脱敏中的作用后,实验组进一步的工作发现b-肾上腺素受体激酶(bARK)也介导受体的脱敏(Benovic,Mayor et al.1986)。1990年Lohse的实验数据表明bARK发挥受体脱敏的作用需要一个辅因子的参与,该辅因子与稍早先发现的视觉的arrestin蛋白高度同源,所以命名为b-arrestin(Lohse,Benovic et al. 1990)。
1991年,实验室的Lorenz等人克隆出b-肾上腺素受体激酶(bARK),发现b-肾上腺素受体激酶(bARK)和催化反应的视紫红质激酶(RK)在氨基酸序列上有高度同源性(Lorenz,Inglese et al.1991)。通过对两者共同结构的归纳研究及一些功能实验,实验室推断并克隆出特异介导GPCR脱敏的一个新的蛋白激酶家族GRK(Gprotein coupled receptor kinase)(Arriza, Dawson et al. 1992;Lefkowitz, Inglese et al. 1992; Pei, Tiberi et al. 1994; Pei,Kieffer et al. 1995)
图7:ARGs复合物结构图A:AR与G蛋白复合物结构。图B:AR-Gs蛋白复合物中G蛋白循环示意图。G蛋白聚合过程与GPCR与效应分子通过膜结合的异源三聚体(亚...
综上所述,通过对b2肾上腺素能受体脱敏的研究,Lefkowitz研究小组与其他小组一起阐明了磷酸化, PKA,GRK和b-arrestin(b-抑制蛋白)在受体脱敏中的作用,发现了GRK家族。除磷酸化介导的脱敏外,进入21世纪,实验室也率先发现了受体的其他后修饰在细胞信号转导过程中的作用,包括泛素化等(Shenoy,McDonald et al. 2001)。
3)b-抑制蛋白(b-arrestin)介导的独立于G蛋白的信号转导系统
b-arrestin最早是在受体脱敏的研究中被发现的,它可以介导受体内吞并终止G蛋白的信号途径,但近十几年的研究发现它也可以独立介导信号转导。1999年,Lefkowitz实验组的Luttrell发现b-arrestin作为衔接蛋白,同时与激动剂结合受体和c-Src结合,起到“募集”并激活c-Src的作用(Luttrell,Ferguson et al. 1999)。
继而,实验室相继发现b-arrestin可介导JNK3,ERK2,PDE4,DGK等重要信号转导因子的激活以及它们介导的下游生理功能,而实验室蛋白组学的研究丰富了这一发现(McDonald,Chow et al. 2000; Luttrell, Roudabush et al. 2001; Perry, Baillieet al. 2002; Nelson, Perry et al. 2007; Xiao, Sun et al.2010)。针对同一个受体,不同的配体可能会引起不同的受体磷酸化,从而引起不同的arrestin构型改变。
其中,以血管紧张素受体II(A1TaRII)为模型,arrestin独立的ERK激活以及其下游途径得到了详尽的阐释,最终导致了偏向性配体概念的提出并应用到新型的药物发展当中(Wei,Ahn et al. 2003; Ahn, Shenoy et al. 2004; Shukla, Violin et al.2008)。
4b2肾上腺素能受体(扩散型配体的GPCR)的晶体结构
自G蛋白偶联受体被发现以来,人们一直试图了解这些蛋白传递胞外信号至细胞内部的作用机制,这就必然需要获得了关于他们结构的信息。而蛋白质晶体结构可以提供原子层级的高分辨率结构信息,具有重大价值。除视紫质(Rhodopsin)之外,G蛋白偶联受体家族成员在细胞内的丰度很低,容易被降解而失活,且具有复杂柔韧的跨膜结构,因此GPCR家族成员高分辩率的晶体结构一直未能被解析,从而在很大程度上制约了我们对G蛋白偶联受体功能的研究,阻碍了新药的研发,成为长期以来在结构生物学和药物学研究中的重大挑战(Lefkowitz,Sun et al. 2008)。
1)序曲
获得纯化的肾上腺素能受体以后,Lefkowitz就开始尝试结晶GPCR的可能性。而从克隆肾上腺素能受体开始,Kobilka也把肾上腺素能受体的结构分析作为自己下一个奋斗的主要目标。Kobilka从离开Lekfowitz实验室开始,开始了15年的独自奋斗解析肾上腺素能受体结构的历程。
扩散型配体的GPCR丰度很低,在纯化过程中很快失活。1979年,Lefkowitz实验室成功建立了一套便捷快速高效的肾上腺素受体亲和层析的方法,也发展了肾上腺素受体的抗体,可以用于大规模制备具有活性的肾上腺素受体(Caron,Limbird et al. 1979; Caron, Srinivasan et al. 1980)。
此外,Kobilka在Lefkowitz实验室工作时,通过构建a和b肾上腺能受体的融合蛋白和拆分其不同片段,不仅阐明了GPCR受体的第五个a螺旋的氨基端到第六个a螺旋羧基端的区域对G蛋白的结合起关键作用,而第七个跨膜结构域与激动剂和阻断剂的结合密切相关;也发现重组表达非共价键相连的肾上腺素能受体1-5跨膜区域与6-7跨膜区域两个片段可重组为有活性的受体(Kobilka,Kobilka et al. 1988)。
这些工作为日后GPCR蛋白结构的研究,尤其是在受体的第三个胞内环插入溶菌酶这一天才型的想法做了重要的铺垫(Lefkowitz, Sunet al. 2008)。
2)突破
除肾上腺素能受体自身的研究,蛋白晶体学领域也在进展,包括1997年Mackinon用抗体的方法制备了离子通道的晶体,以及脂立方(lipidcubic phase)技术的发展,使获得高分辨率的肾上素能受体晶体结构成为可能。
Kobilka同时通过与抗体共结晶和在第三个细胞内环插入溶菌酶两个手段几乎同时获得了b2肾上腺素能受体的晶体。其中溶菌酶插入的晶体利用了脂立方技术,与Stevens一起合作完成。这一系列文章几乎在同一个月先后发表在Nature,Science和Nature Method上(Cherezov, Rosenbaum et al. 2007; Day,Rasmussen et al. 2007; Rasmussen, Choi et al. 2007; Rosenbaum,Cherezov et al. 2007)。
在Kobilka实验室成功解析了除视紫质(Rhodopsin)之外的第一个GPCR晶体结构后,利用溶菌酶插入技术,G蛋白偶联受体晶体结构的研究进入了一个活跃期,大量G蛋白偶联受体或者受体复合物的结构被解析,其中包括:人类A2A腺苷受体、人类多巴胺D3受体、乙酰胆碱受体和鸦片受体等(Wu,Chien et al. 2010; Granier, Manglik et al. 2012; Haga, Kruse et al.2012; Hanson, Roth et al. 2012; Kruse, Hu et al. 2012; Manglik,Kruse et al. 2012; Thompson, Liu et al. 2012; Wu, Wacker et al.2012)。
3)G蛋白偶联受体的激活构型和多重构型
激动剂(Agonist)作用于细胞受体后,会显著改变受体的构象,从而将信息传递下去,这种与激动剂结合的受体构象通常被称为GPCR的激活构型。GPCR受体激活结构的获得主要存在两个方面的困难:第一,在G蛋白未与GPCR结合的情况下,受体与配体的亲和力较弱,并且配体解离的速度很快,很难捕捉到他们共存。第二,受体激活的构型相对于失活的构型非常不稳定,不利于结晶。
为克服这些困难,Kobilka实验小组同时采用了共价修饰的b2肾上腺素能受体激动剂和应用羊驼产生的纳米抗体nanobody结合的方法,得到了激动剂结合的激活状态的受体结构,观察到跨膜螺旋发生了显著重构,以及受体的细胞第二内环变构为a螺旋(Rasmussen,Choi et al. 2011; Rosenbaum, Zhang et al. 2011)。
在设法解析与激动剂结合的受体激活状态的同时,Kobilka实验小组应用荧光标记和核磁共振技术,Lefkowitz实验小组应用质谱解析技术,证明了多个不同的肾上腺素能受体的配体可以引起受体的多种不同构型(Yao,Parnot et al. 2006; Bokoch, Zou et al. 2010; Kahsai, Xiao et al.2011)。
5b2肾上腺素能受体与G蛋白复合物的晶体结构
受体与激动剂结合后,不仅自己发生构型改变,还必须与下游效应器分子进行耦联,并诱使其结构发生改变,从而将生物信号传递到细胞内。原子分辨率的晶体结构对理解这一重要生命活动至关重要。
Kobilka小组在获得b2肾上腺素能受体的晶体结构后,就开始向解析受体与G蛋白复合物的结构开始迈进。GPCR激活后,会与GDP结合的G蛋白三聚体结合,然后G蛋白三聚体解离,G蛋白与GTP结合(图7B)。G蛋白三聚体与GPCR的结合非常短暂,其复合物的结构很难捕捉。
除了应用解析GPCR活性状态结构所用的能与GPCR形成共价键的激动剂以及纳米抗体之外,Kobilka还采用了三种新的手段,包括(1)将溶菌酶放在了蛋白的N端,(2)在受体与G蛋白三聚体复合物结合后,应用Aprase将GDP除去,(3)并应用了一种新发现的去垢剂MNG-3。纳米抗体技术的应用在稳定复合物结构和受体激活的构型中都起到了最关键的作用。这些新方法的应用终于使Kobilka成功获得了受体与G蛋白复合物的晶体结构(Rasmussen,DeVree et al. 2011)。
与受体激活的状态相似,GPCR与G蛋白复合物的结构中胞内第二内环重构为螺旋和而跨膜螺旋发生了重排。复合物的结构进一步揭示了G蛋白的N端和C端的a螺旋介导了主要G蛋白构型变化,尤其是a螺旋5移动了6Ǻ,并插入b2肾上腺素能受体,并最终导致GαsAH亚基旋转127°,从而打开G蛋白的核酸结合口袋。Kobilka的这一成就使人类第一次看到了GPCR与G蛋白结合的分子细节,对理解生命中细胞水平上的信息传递机制具有重要意义,其揭示的一些内容需要在未来的研究中得到进一步消化和理解。
图8:金属离子依赖的嗅觉受体响应气味分子的机制 (改自Wang, Luthey-Schulten et al., 2003)带负电的连接嗅觉受体第4和5跨膜区域的细胞外环与金属离子结合后呈电中性状态,随后内化进入细胞膜并导致第4跨膜区域进入 ...
6展望
虽然人们对GPCR信号转导和功能的认识逐步加深,但GPCR家族中还存在许多孤儿受体,其配体未知,而已知受体可能还有未被发现的配体。阐明这些受体的配体,发现它们介导的信号转导机制具有重要的生理学意义和药理学价值,需要投入大量的研究资源。
同一GPCR受体往往可以激活一段时间,可以同时偶联几种G蛋白,也会与Arrestin等其他蛋白相互作用。GPCR的偏向性配体的概念经Lefkowitz实验室提出后,已经成为GPCR药物发现的下一个研究热点(Violinand Lefkowitz 2007; Gesty-Palmer, Flannery et al. 2009; Boerrigter,Soergel et al. 2012; Dong, Chen et al. 2012; Kim, Abraham et al.2012)。
偏向性配体可能不止涵盖于不同的G蛋白,Arrestin,也可包括许多未发现的蛋白,值得我们进一步深入研究和利用。
在结构方面,虽然第一个G蛋白与GPCR的复合物已经得到解析,但该结构不能解释受体与G蛋白偶联的选择性和识别的保守序列,这些需要其他GPCR与更多的G蛋白,包括Gq,Gi等的复合物的结构解析。受体与Arrestin形成复合物及受体内吞复合物的结构也期待解析。
G蛋白偶联受体相应配体结合会有多重构象,其动态构象变化还可能有多种形式(Wang, Luthey-Schulten et al.2003)。这些知识对我们理解生命现象,阐释生命本质具有重要意义。
G蛋白偶联受体(7次跨膜受体)在信号转导过程和药物开发中占据着核心的位置,关于GPCR的研究极大改变了我们对生命活动的认识以及革新了现代医药研究。这次的诺贝尔化学奖,不仅是对这两位生物化学家在G-蛋白偶联受体发现、鉴定及结构生物学研究重要贡献的褒奖,同时也是对有机化学家和药物化学家创造性工作的肯定。目前的处方药中,有50%以上的药物靶点是G蛋白偶联受体。正是由于有机化学家和药物化学家合成并筛选了大量的药物分子,才使得G-蛋白偶联受体研究走出实验室,为人类创造了巨大的福祉。
没有有机化学家和药物化学家的贡献,G蛋白偶联受体的研究只能停留在基础研究阶段。与GPCR有关的研究已经获得了5次诺贝尔奖,但还有许多重要问题没有解决。例如:怎样依据G-蛋白偶联受体结构及动态构象变化信息,设计筛选出更加高效,副作用更小的药物?G-蛋白偶联受体是通过怎样的动态构象变化,将膜外的信息传递到膜内的?
科学家们将进一步努力,更好的阐明GPCR的作用机制和功能,我们期待GPCR领域的下一个诺贝尔奖。
注1此文已被《生物化学与生物物理进展》接收,将刊登于2012年11月刊
注2:关于有些人询问Kobilka和Lekfowitz在这项工作中的贡献,
这是同时在Dixon和Lefkowitz两个实验室都工作过的相关人员的描述:
Both labs are important for the work.While Bob (lefkowitz)’s lab play the major role. For the facts, Boblab developed the methods for solubilizing and purifying the beta 2receptor using ligand affinity chromatography and forcharacterizing the purified protein using radioligand binding.These contributions were essential to obtain peptide sequence ofthe purified receptor protein from with the nucleotide sequence wasderived. The Dixon group and merck had been using the sequence topull clones out of conventional cDNA libraries without success.Brian (Kobilka) generate a genomic library which was screened atboth Duke and merck. Both groups pulled out thefull length genomic clone from this library at about the same time.The success of the effort was largely due to work done in Bob'slab. First authors and last authors don't always contribute themore important science.
基本翻译过来是,Lefkowitz和Kobilka在第一篇克隆文章里起到了主要作用,包括获得蛋白序列,产生并应用基因组克隆等。第一和最后一个作者并不总是最主要的贡献。最近Benovic会有一篇Cell文章继续讲这GPCR获奖的事,请大家关注。
中文摘要:
2012年度诺贝尔化学奖被授予两名美国科学家,罗伯特•洛夫科维茨(Robert J.Lefkowitz)和布莱恩•克比尔卡(Brian K.Kobilka),以表彰他们在G蛋白偶联受体(GPCR)的发现和工作机理研究方面所做的奠基性贡献。
G蛋白偶联受体不仅构成了细胞信号转导中最重要的模块系统,同时它们还是半数处方药物的作用靶点。从20世纪70年代开始,Lefkowitz通过专注于研究“战斗或逃离-激素”的受体—肾上腺素能受体,并不断在技术上探索和更新,一直引领着GPCR的领域的发展。
Lefkowitz的贡献包括却并不仅仅限于:通过放射性标记配体而证明GPCR的存在,提出三元化合物模型(Ternary complexmodel),揭示了受体脱敏和磷酸化调节的机制,以及受体的偏向性信号转导(receptor biasedsignaling)。Lefkowitz和Kobilka克隆了第一个以扩散型化合物为配体的GPCR基因,明确了GPCR超家族的存在。
Kobilka在独立实验室后,通过长时间的摸索,打破了扩散型配体GPCR的结晶瓶颈并成功解析了第一个GPCR/G蛋白复合体结构。目前我们关于GPCR的知识很大程度上受益于Lefkowitz和Kobilka的开创性工作。
随着对GPCR工作机理的深入认识以及新技术的发展,GPCR领域正在酝酿更大的进展,包括孤儿GPCR功能鉴定,GPCR与效应分子(如arrestin)所组成复合体的结构解析,以及基于受体结构信息的新药的研发。这些进展,不仅会帮助我们理解生物信号转导的细节,而且将会给临床重大疾病的诊疗提供新的方案。
此文来自"科学网"
 爱华网
爱华网


