脊髓损伤(spinal cordinjury)是指由于外界直接或者间接因素导致脊髓损伤,在损害的相应节段出现各种运动、感觉和括约肌的功能障碍,使肌张力异常及病理反射等的相应改变。
分类:
根据脊髓损伤的发病机理大体可分为原发性脊髓损伤和继发性脊髓损伤
1.原发性损伤
指外力直接或间接作用于脊髓所造成不可逆的损伤.
如:外伤性骨折的移位、脱位引起椎间盘脱入椎管或骨折碎片刺入脊髓造成的脊髓压迫、冲击、挫裂及剪切伤。
2.断发性损伤
指原发性损伤的基础上所造成的脊髓水肿、椎管内小血管出血形成血肿、压缩性骨折错位以及碎的椎间盘组织等形成脊髓压迫所造成的脊髓的进一步损害。
损伤机制图:
1) 原发性损伤
原发性损伤部位的直接由机械力量剪切神经细胞和内皮细胞的胞膜,由于灰质区柔软并富于血管,首先在这些区域形成出血坏死灶。损伤后的组织引起不均衡移动,也会在中心区出现出血,造成相关神经细胞膜和结缔组织的剪切损害。由于脊髓表面组织移动相对较小,硬脊膜附近的轴突常可存活下来,而灰质附近的轴突在SCI后受到严重损害。因此,随着脊髓压缩的持续,会发生特殊的分子和细胞机制,进一步演化为继发性损伤。
2) 继发性损伤
原发损伤尽管可直接造成损伤部位细胞死亡,但脊髓更大的损伤主要源于继发性损伤机制的存在。
2.1 坏死 继发性损伤机制引起的坏死波在8h后不可逆,并可沿原发损伤区向上下扩展两个椎体水平。
2.2 梗死 梗死扩大了CNS( centralnervous system)组织的坏死,并显著损伤神经元。原发性损伤可造成小动脉,毛细血管和小静脉的损害,从而限制脊髓组织的血流供应。继发性损伤进一步加重了梗死,这些机制包括血管痉挛,血栓形成和神经源性休克,其中神经源性休克可造成心动迟缓,低血压,外周阻力降低和心输出量减少。在细胞水平,则表现为氧化磷酸化和糖酵解途径丧失,ATP缺乏致使细胞膜通透性丧失,溶酶体内容物释放和钙依赖性自我破坏酶的激活,从而导致细胞死亡。
2.3 兴奋毒性作用 SCI后,由于谷氨酸再摄取障碍,钙离子依赖性谷氨酸突触囊泡的胞吐作用以及细胞裂解致使胞内谷氨酸释放,使得谷氨酸能环路被放大,胞外谷氨酸浓度持续上升。大量的胞外谷氨酸过度刺激它的离子型谷氨酸受体NMDA,AMPA和红藻氨酸盐,通过诱发兴奋性波导致细胞死亡。兴奋毒性作用可通过钙离子依赖机制导致神经细胞死亡。在这个机制中,慢性去极化使钙离子通过电压依赖钙离子通道向胞内大量内流,并打开NMDA受体通道。钙离子内流可由于胞内钙离子库的钙动员和胞膜钠/钙逆交换进一步被增强,最终激活自身破坏钙离子依赖酶,从而引发细胞死亡。
2.4 再灌注损伤 SCI后的前几天,再灌注会加生脊髓组织的损伤。在缺血过程中,内皮细胞中的黄嘌呤脱氢酶发生限制性蛋白水解,经过修饰后转变为黄嘌呤氧化酶,可把电子转化为分子氧。当内皮细胞再次暴露于氧时,会导致酶反应并产生活性氧族(ROS)。
进一步对组织造成损伤。ROS可通过改变CNS细胞的脂质,蛋白或核酸对CNS的细胞造成损害。在胞浆和细胞器的膜上,自由基可通过攻击不饱和脂肪酸的双链导致脂质过氧化。这个脂质-自由基相互作用可产生过氧化物,进一步加重膜损伤。最近研究也发现ROS倡导损害中一个关键的介质是超氧自由基和NO形成的过氧自由基,在大鼠SCI模型中,过氧自由基与神经元调亡直接相关。
2.5 凋亡 SCI后,凋亡在继发性损伤中起重要作用。凋亡通过两个阶段发挥作用:初始阶段,凋亡伴随着坏死发生在多种类型细胞的变性中;在晚期阶段,则主要局限于白质中包括少突胶质细胞。损伤后6h凋亡起始于损伤中心,此后数天内该区域的调亡细胞稳步增加。在1周时,凋亡数目开始减少,在远离原发损伤部位的调亡细胞则增多。凋亡主要由Fas传导,干预该途径有潜在疗效。SCI后,Fas配体主要表达在小胶质细胞和入侵的淋巴细胞上,而FasR的可溶成分可阻断SCI中Fas介导的细胞死亡。
2.6 轴突瓦解和华勒变性 SCI后15min,轴突周围即可出现肿胀,髓鞘板层之间相互远离,也可伴有髓鞘的破裂,在24h时,胞外间隙中可见到轴突成份。随着时间的推移,可看到损伤轴突广泛脱髓鞘和异常中断的生长锥。这些突变化最终伴有华勒变性,在啮齿动物中持续数月,在人类中可持续数年。华勒变性从纤维变性开始,伴有相关髓鞘的碎裂。继而有碎片的聚焦,并有巨噬细胞和小胶质细胞吞噬碎片。
2.7 胶质瘢痕 组成胶质瘢痕的最早成分来自髓鞘和少突胶质细胞的碎片,还有在原发损伤中存活下来的少突胶质细胞。随军后有小胶质细胞的激活和迁移入胶质瘢痕。不久,脊髓中央管的多分化潜能的前体细胞也侵入损伤部位。胶质瘢痕发展的终止点是星形胶质细胞的迁移和增殖,星形胶质细胞可渗入原发损伤形成的空腔中,并最终形成大量的胶质瘢痕。
2.8 轴突生长抑制分子 胶质瘢痕及周围的环境覆盖有多种促使受损神经元的生长锥崩解的分子。这些分子和胶质瘢痕一起形成了抑制轴突再生的分子和机械屏障。一般来说,SCI后表达上调的抑制性分子可分为两类:1)髓鞘相关性抑制分子。2)胶质瘢痕的细胞成分合成的分子,这些分子要么留在细胞表面要么被分泌到细胞外基质中。由胶质瘢痕的细胞成分合成的抑制性分子双可分为两类。第一类只对神经突起起作用,这些分子是蛋白多糖,特点是包含葡萄糖胺聚糖酸(AGAGs的无分支重复双糖单位。硫酸软骨素蛋白多糖(CSPGS)是重要的抑制性蛋白多糖亚族,这个亚族包括NG2.神经多糖。多聚糖。磷多糖,其AGAGs是硫酸软骨素。第二类抑制性分子对轴突生长有抑制和促进效应。
这类分子有黏蛋白(黏蛋白R.C和X),许多黏蛋白抑制神经突起的生长。该类成员中还包括在发育过程中起轴突导向作用的导素和信号素,在SCI轴突的再生中起抑制作用。
综上所述,我们可以知道SCI由原发和断发损伤共同引起功能障碍,了解以上这些病理机制对于治疗些种疾病,促进损伤后神经再生和功能恢复有重要意义。
药物治疗方法:
(1)地塞米米松,10-20mg静脉滴注,连续应用5-7天后,改为口服,每天3次,每次0.75mg,维持2周左右。
(2)甘露醇,20%甘露醇100-250ml静脉滴注每日2次,连续5-7次。
(3)甲基泼尼松龙,冲击疗法每公斤体重30mg剂量一次给药,15分钟静脉注射完毕,休息45分钟,在以后23小时内以5.4mg(kg/h)剂量持续静脉滴注,本法只使用于受伤后8小时内者。
(4)高压氧治疗。据动物实验,伤后2小时进行高压氧治疗效果最好,这显然不适合于临床病例根据实验经验,一般伤后4—6小时内应用也可收到良好的效果。
地塞米松是维持性治疗脊髓损伤的药物,但难以达到很好的治疗效果。所以应根据自身情况选择积极有效的治疗方法。细胞渗透修复疗法经临床验证,是目前治疗脊髓损伤的最好方法。细胞渗透修复疗法应用于临床,通过自我复制分化可以诱导分化成骨细胞,软骨细胞,脂肪细胞,肌细胞,神经元及心肌细胞。神经系统疾病必须恢复神经元细胞才能治愈,所以细胞渗透修复疗法是治疗脊髓损伤疾病的首选!
细胞渗透修复疗法:
在实用细胞渗透修复疗法治疗之前的前提(具备条件):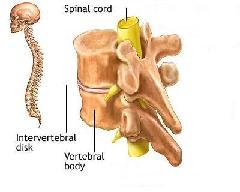
1)要选择合适的供体细胞。胚胎干细胞的优势在于具备无限增殖与分化的能力。理论上神经干细胞毋庸置疑在治疗中枢神经系统疾病中具有绝对的优势,但也存在着取材困难、培养、纯化等问题;间充质干细胞取材方便、来源广泛、免疫原性弱等方面优于神经干细胞,但是目前掌握的研究资料不多,尚无充分的证据说明它是更理想的种子细胞。
2)选择合适的移植方案以保证临床收益最大。需要考虑的因素包括移植细胞的保存方式、移植数量、靶点选择、免疫抑制剂的应用等。
3)证明这些移植细胞的安全性。
细胞渗透修复疗法是一项可以放心的采用细胞渗透修复疗法。因为它不但可以治疗多种疾病,而且副作用小,安全可靠。
高压氧治疗:
有文献表明高压氧治疗对不完全脊髓损伤功能恢复有促进作用,且越早效果越好.
目的:进一步探讨超早期高压氧治疗对脊髓完全横断损伤大鼠骨转换的影响.
方法:SD大鼠随机分为假手术组、模型组和高压氧组,假手术组仅行椎板切除术,其余2组均行T_(10)椎板水平脊髓完全横向切断术.高压氧组于术后第3小时置于动物舱内开始高压氧治疗,舱内达到222.92kPa个绝对大气压,吸氧浓度97%~99%,10d1疗程,共3疗程,其中第1疗程2次/d,第2,3疗程1次,d,每疗程间休息6d.模型组不做高压氧治疗.分别于建立模型后第6周处理,用ELISA法测骨形成指标血清骨特异性碱性磷酸酶及血清骨钙素,骨吸收指标血清Ⅰ型胶原氨基末端肽及尿脱氧吡啶啉的浓度.
结果与结论:高压氧组大鼠血清骨特异性碱性磷酸酶,血清骨钙素值显著高于模型组(P<0.05),模型组显著高于假手术组(P<0.05).高压氧组血清Ⅰ型胶原氨基末端肽,尿清脱氧吡啶的值显著低于模型组(P<0.05),模型组显著高于假手术组(P<0.05).结果表明超早期高压氧治疗可影响脊髓完全横断损伤大鼠骨转换的改变,对骨形成有促进作用,对骨吸收有抑制作用.
 爱华网
爱华网