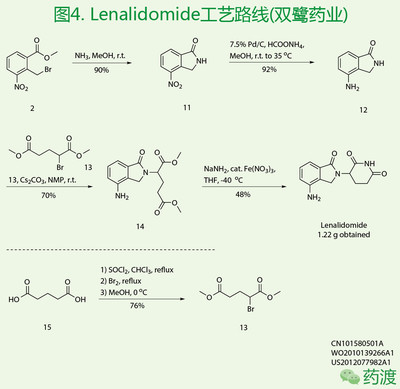
双鹭药业来那度胺制剂已申报生产
大智慧阿思达克通讯社11月6日讯,双鹭药业(002038.SZ)在互动平台上称,来那度胺制剂近期已申报生产。大智慧通讯社(dzh_news)查询国家食品药品监督管理总局(CFDA)网站发现,该药目前未有批准厂家,而原料药来那度胺双鹭药业在今年8月也已申报生产。
公司内部人士表示,子公司卡文迪许已获得来那度胺的组合物专利,该产品公司系挑战全球专利,目标是全球市场。该药物的国内权益归双鹭所有,中国以外的市场归卡文迪许所有,双鹭可拥有40%。
来那度胺是美国Celgene开发的新一代抗肿瘤药,其有效成分是来那度胺(lenalidomide),主要用于治疗慢性骨髓瘤和有5q缺失的骨髓增生异常综合症(Myelodysplasticsyndrome,MDS),骨髓增生异常综合症是一种恶性血液疾病,全球约有30万患者,发病率约为10/10万‐12/10万,多累及中老年人,50岁以上病例占50%‐70%。根据美国Celgene公司年报显示,来那度胺2013年销售收入42.8亿美元,同比增长13.6%,其中在美国的销售约占一半。
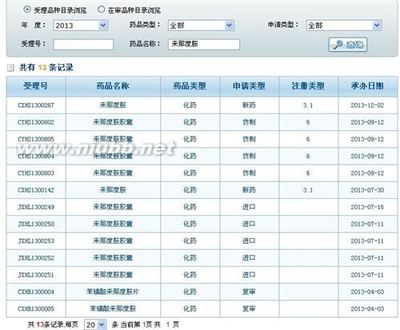
目前,国内尚无该药上市,仅有新基欧洲有限公司完成进口注册申请。此外,还有3家企业向CFDA提出来那度胺制剂临床注册申请。
问:请问来那度胺申报生产了没有,如申报能否走绿色通道(2014-10-2814:33:43)
双鹭药业:已申报,第一家申报,已申请。(2014-11-03 15:44:10)
问:梁董秘,您好。请问,你刚才说的来那度胺已报生产,是指来那度胺胶囊制剂吗?还是8月报生产的来那度胺原料药呢?谢谢!(2014-11-0315:53:14)
双鹭药业:是制剂。谢谢关注。(2014-11-05 11:05:42)
已申请的意思是不是已经申请了绿色通道。前三家申报先批的做法取消了,绿色通道没有取消?
来那度胺不存在他人抢先,只有双鹭一家申请并做了临床。其他家临床申请都没有。图中的临床申请是双鹭的。双鹭的制剂申报应该在11月进入国家局并获CDE受理。
本贴只作为信息交流不作为推荐股票
 爱华网
爱华网