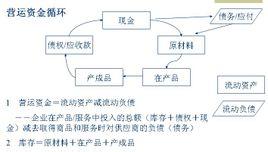
硝酸的计算
与硝酸有关的计算由于涉及到原子守恒、得失电子守恒,所以在题目中较为常见,在实际问题中硝酸有关的计算主要可归纳为以下几种情况:
1、依据得失电子守恒的计算
例1:1.92g铜投入到一定量浓硝酸中,铜完全溶解,生成气体颜色越来越淡,将收集到的气体与一定体积的氧气混合于试管倒立于水槽中,恰好使所有气体完全溶于水,则通入氧气的体积为
A 504mL B 336mL C 224mL D 168mL
解析:分析题意,从电子转移角度可知,Cu和HNO3反应时,Cu是还原剂失去电子,形成氧化产物Cu(NO3)2;HNO3是氧化剂得到电子,形成还原产物NO2、NO、N2O4等,依据得失电子守恒可知,Cu失去的电子与HNO3得到的电子相等。氮氧化物与O2混合完全溶于水形成HNO3,O2是氧化剂,得到电子,氮氧化合物是还原剂失去电子,得失电子守恒,从整个反应过程来看,相当于O2得到了Cu失去的电子,2n(O2)=n(Cu)=0.03mol,V(O2)=336ml。答案:B。
例2:铜和镁的合金4.6g完全溶于浓硝酸,若反应后硝酸被还原只产生224ml的NO气体4480ml和NO2 的气体(标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A 9.02g B 8.51g C 8.26g D 7.04g
解析:依据题意,反应过程为Cu、Mg被HNO3氧化失去电子形成Cu2+和Mg2+,HNO3得到电子形成还原产物NO和NO2,NO和NO2,向反应后的溶液中加入足量的NaOH形成Mg(OH)2 和Cu(OH)2沉淀,Cu2+和Mg2+结合的OH-的物质的量与两金属失去电子的物质的量相等,依据NO和NO2体积可得HNO3得到电子物质的量为0.23mol,依据得失电子守恒可知,两金属失去的电子也为0.23mol,沉淀的质量为4.6g+0.23×17g=8.51g。答案:B。
2、依据原子守恒的计算
例3:若将12.8g铜与一定量的硝酸反应,铜消耗完时,共产生NO和NO2的混合气体5.6L(标准状况)。则所消耗的硝酸的物质的量为
A 0.5mol B 0.6mol C 0.65mol D 0.7mol
解析:Cu与HNO3反应生成Cu(NO3)2、NO、NO2和H2O,依据氮原子守恒可知,消耗的HNO3物质的量等于2n(Cu(NO3)2)+n(NO)+n(NO2),n(HNO3)=0.4mol+0.25mol=0.65mol。答案:C。
3、依据原子守恒和得失电子守恒的计算
例4:某浓度稀HNO3与金属M反应时,能得到+2价硝酸盐,反应时M与HNO3的物质的量之比为5∶12,则反应时HNO3的还原产物是
A NH4NO3 B N2 C N2O D NO
解析:依据题意,金属形成+2价硝酸盐,假设金属M为5mol,则消耗的HNO3为12mol,由于5mol金属M在生成物中形成+2价硝酸盐,则未被还原的硝酸为10mol,由于共12molHNO3参与反应,则2molN原子得到10mol电子,平均每摩尔氮得到5mol电子。答案:B。
4、有关离子方程式的计算
例5:将1molKNO3和4molH2SO4溶于1L水,向其中加入1.5mol铜粉,充分反应后产生的气体在标准状况下的体积是
A 5.6L B 11.2L C 22.4L D 33.6L
解析:由于硝酸是强电解质,在溶液中以H+和NO3-的形式存在,而在与金属的氧化还原反应中消耗的H+和NO3-的量不相同,所以在计算中经常需要用到离子方程式。依据3Cu+8H++2NO3-=3Cu2+ + 2NO + 4H2O,可知Cu、H+、NO3-三者相比较,Cu、NO3-少量,H+过量,所以依据Cu或者NO3-的物质的量计算,可得气体体积为22.4L。答案:C。
5、讨论型计算
例6:某单质和浓硝酸反应时,每有0.25mol 单质反应就消耗1mol硝酸,反应中浓HNO3还原为NO2,则单质元素氧化后的化合价可能是
A +1 B +2 C +3 D +4
解析:若单质为金属,可能形成+1、+2、+3价,依据得失电子守恒和原子守恒,只有为+2价的金属才能满足0.25mol 单质反应就消耗1mol硝酸;若单质为非金属,则硝酸中的氮元素全部转化为NO2,依据得失电子守恒,非金属氧化后为+4价,单质碳就可以符合。答案:B、D。
例7:含有ngHNO3的稀硝酸跟mg铁粉充分反应,铁完全溶解,生成一氧化氮气体。已知反应中有n/4 gHNO3被还原,则n∶m不可能是
A 3:1 B 3:2 C 4:1 D 9:2
解析:铁与稀硝酸反应,生成物中铁的存在形式可能有三种情况:
(1)全部为Fe3+
(2)全部为Fe2+
(3)既有Fe3+,又有Fe2+。
若为情况(1):
未被还原的HNO3生成Fe(NO3)3,依据原子守恒,应有3n(Fe3+)=n(NO3-),
可得n∶m=9∶2
若为情况(2):
未被还原的HNO3生成Fe(NO3)2,依据原子守恒,应有2n(Fe3+)=n(NO3-),
可得n∶m=3∶1。
若为情况(3):
消耗HNO3应在(1)和(2)之间,即3/1< n/m <9/2。答案:B。
 爱华网
爱华网