(本文刊载于《化学教育》2014年15期)
摘要关键词(略)
1 问题的提出
中学化学知识中陈述性知识占有重要位置。一般地说,化学陈述性知识包括化学中具体的、各自相对独立的有关物质组成、性质、结构、化学反应及其具体应用的知识,包括典型的化学事实性知识和最基本的化学概念和化学原理知识。中学生通过一定量的典型的化学事实性知识的学习,分析、比较、归纳、抽象和概括,可以理解和掌握最基本的化学概念和化学原理。在深刻理解典型的化学事实和核心概念的基础上,通过自己的思考、体会和知识的运用,可以领悟和内化这些知识中所蕴含的化学基本观念,提升科学素养。
研究化学陈述性知识的认知方式和表征,从陈述性知识的教学结构和学习程序两个方面改进教学设计,可以帮助学生提高化学事实性知识的理解和掌握程度,提高教学实效。
2 化学陈述性知识的认知方式与心理表征
化学是从原子分子水平上认识物质及其变化的科学。物质的微观世界,难以通过感官直接感知。化学知识的学习,一般需要通过对物质世界的宏观事物及其变化的观察和实验探究,运用模型化方法和分析、归纳、推理、假设和论证等逻辑思维方法,领悟物质及其变化的微观过程,形成一系列化学基本概念,获得最基本的化学原理知识,并借助化学符号系统做分析描述。从宏观现象入手,在微观层次做分析研究,借助化学符号系统做描述,是化学陈述性知识的认知方式。
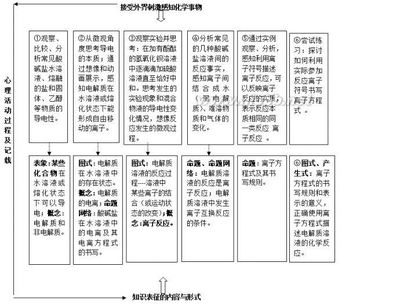
借助认知心理学关于知识心理表征的理论,可以比较清晰地描述化学陈述性知识的学习过程。认知心理学把信息或知识在心理活动中的表现和记载称为知识的心理表征。人脑接受外界刺激和信息,把获得的感受贮存在感觉记忆中,通过复述,保持在短时记忆(工作记忆)中,而后通过编码、转换、存储和提取等加工过程贮存入长时记忆。人脑还能从长时记忆中提取信息,进入短时记忆并和新的感受整合、加工,再转入长时记忆或形成反应生成器,对外界刺激作出反应。人脑对知识的表征包括内容和形式两个方面。内容即知识的实际信息;形式即表达内容的方式。信息的加工、编码和存储的形式,可以是表象、概念(和概念系列)、命题(和命题网络)、图式、组织形式和产生式。从表象、到概念、命题到图式和产生式,学习者对知识的理解、掌握程度和应用能力逐步提高。
例如,中学化学中有关电解质电离和离子反应知识的表征可用下图做简要说明。
图1 电解质溶液基础知识的心理表征
3 借助个体认知方式和心理表征诊断学习存在的问题
每个个体在学习过程中认知方式不尽相同,对所学的知识的表征也并不完全一样,他们对所学知识的理解、掌握程度、学习成效也不同。从个体对知识的认知方式和心理表征可以诊断学习存在的问题。
以中学生对电解质电离、离子反应知识的理解和掌握为例。一些学生对电离、离子反应的定义,会做文字表述,也记得住。但是,要对电解质溶液间的离子互换反应做分析、描述,往往难以下手。他们往往不关心反应是怎么发生的,而是为怎么书写化学反应的离子方程式而纠结,不知道某个反应物、生成物要用化学式还是离子符号来表示,也不清楚哪些离子应该或不应该写入离子方程式。为了完成习题,他们往往硬生生地套用离子方程式书写的四字口诀(“写、拆、删、查”)。在写出反应化学方程式后,随意拆、删化学方程式中的反应物、生成物的化学式,凭臆断拼凑出错误的“离子”方程式。对这些学生做访谈,可以发现他们的认知方式不科学,脑子里对电解质电离、离子反应的知识的表征很不完善,甚至模糊不清。他们的脑子中没有电解质在溶液中存在的微粒的图像,对参加反应的电解质在溶液中的存在状态、运动和变化没有“感觉”。他们缺乏对电解质及其电离的表象,在他们脑子中,盐酸溶液、醋酸溶液、氢氧化钠、醋酸钠溶液只是对应于符号HCl、CH3COOH、NaOH和CH3COONa,没有意识到盐酸溶液是自由移动的氢离子(水合氢离子)、氯离子分散在水中,醋酸溶液的溶质微粒是CH3COOH分子和少量醋酸电离生成的少量的氢离子(水合氢离子)、CH3COO-离子;更没有意识到CH3COOH分子和少部分醋酸电离生成的离子间存在着动态平衡;没有理解氢氧化钠溶液和醋酸溶液混合发生的反应实质上是氢氧根例子与醋酸电离产生的氢离子结合成更难电离的水的缘故。因此,他们难以理解“电解质溶液的反应是离子反应”的命题。若问他们,醋酸溶液、氢氧化钠溶液混合,哪些微粒发生相互作用,他们只能引用化学反应方程式CH3COOH + NaOH === CH3COONa +H2O说明是CH3COOH和NaOH发生中和反应。没有去考虑两种溶液的混合,是哪些离子、分子的混合,也没有考虑哪些自由移动的离子能结合成难电离的分子,不理解为什么可以用离子方程式
CH3COOH +OH- === CH3COO- +H2O表示所发生的反应。事实说明,这些学生对电解质在溶液中的反应的认知,不注意从宏观着眼,做微观分析,只是从反应方程式的书写形式的变化上看待离子反应。他们对电解质电离和离子反应的表征出了问题:脑子中没有形成微观粒子运动、变化的表象,没有建立电解质电离和离子反应的图式;对有关电离和离子反应的概念只停留在定义的文字记忆水平,没有真正形成概念,也没有真正理解和掌握有关电解电离和离子反应的基本原理。
4依据化学陈述性知识认知方式和心理表征设计教学
学生在电解质电离和离子反应的表征上出现的问题提醒我们,在教学设计和组织中应该运用符合化学科学的认知方式,帮助学生进行有效的学习,在内容和形式上正确表征电解质溶液的各项陈述性知识。例如:
(1)从宏观现象的观察入手,感知电解质溶液的导电性,想像或通过实验感知电解质溶液中存在带电的离子,形成电解质电离的表象。
酸、碱、盐等电解质的水溶液中具有自由移动的带电微粒,具有导电性,导电性强弱和溶液中的离子浓度有关,组成相似浓度相同的强酸(碱)、大多数盐的溶液比弱酸(弱碱)溶液导电性强的多。
(2)通过积极的思维活动,加工编码,形成强弱电解质的概念,能用化学符号系统描述发生的电离。
在电解质稀溶液中,存在的自由移动带电微粒是阴阳离子,自由移动的阴阳离子的生成过程被定义为电解质的电离。强电解质与弱电解质,在稀溶液中电离程度不同存在电解质分子、及其电离出的阴阳离子间的动态平衡,弱电解质的电离方程式用可逆符号。
(3)把弱电解质电离的特点和化学平衡原理知识整合加工,形成建立电离平衡的概念系列和命题网络。
在一定温度下,弱酸(碱)的稀溶液中的电力将达到电离平衡状态。可以用电离平衡常数(Ka、Kb)表示相应的平衡常数。依据电离平衡常数的大小可以判断弱酸、弱碱的相对强弱。温度、浓度发生变化,电离平衡发生移动。可以运用化学平衡原理,判断条件变化时电离平衡的移动方向。
(4)通过编码加工,形成弱电解质电离度的概念,建立判断弱电解质相对强弱的命题。
一定浓度的弱电解质(弱酸、弱碱等)溶液,达到达到电离平衡时,已电离的弱电解质的浓度占弱电解质初始浓度的百分数称该弱电解质在该浓度下的电离度。一般说,弱电解质浓度越大,电离度越小。依据相同浓度的弱酸、弱碱的电离度大小也可以判断弱酸、弱碱的相对强弱。电离平衡移动,电离度也发生变化。
(5)建立水是极弱电解质的命题和图式。
水可以电离生成浓度相等的氢离子和氢氧根离子,但电离度很小。在水或水溶液中,氢离子和氢氧根离子的浓度积是一个常数,称为水的离子积Kw(25℃时,Kw=1.0X10-14)。水的电离过程吸热。温度变化、在水中溶解入酸碱和某些盐,水的电离平衡发生移动,可能导致氢离子和氢氧根离子的浓度不再相等,溶液呈现酸性或碱性。
(6)通过宏观现象的观察观察,通过自己的思考,感知并行成电解质溶液间的反应是离子反应的概念,建立离子反应的图式。
例如,利用上述硫酸稀溶液与氢氧化钡稀溶液的中和反应实验等学生熟悉的反应实例,观察、思考反应是怎么发生的,是哪些离子间发生结合的结果,初步感悟“电解质溶液间的反应是离子反应”的概念,在此基础上再通过典型例子的分析,建立离子反应的图式。
从陈述性化学知识的教学设计看,设计的出发点是课程标准规定的学习目标和学生的学习基础,教学设计的归宿应该是能帮助学生以正确的认知方式学习,以正确完整地表征所学的化学知识。
下面再以较为简单的九年义务教育的化学课程关于溶解度知识的教学为例,做简要分析。
九年义务教育课程标准规定有关溶解度的学习目标是:了解饱和溶液、溶解度的含义;提出的有关的学习活动建议是:查阅有关物质的溶解性或溶解度。学生此前已经学习了有关物质溶解性的知识,初步了解了物质在溶剂(水)中溶解的多少,受物质本性、水的用量、温度的影响,建立了饱和溶液和不饱和溶液的概念。
依据这一学习目标和学生的学习基础,通过学习,学生对溶解度知识的表征的内容和形式应包括:
①固体物质溶解度的概念与定义(概念)。
②固体物质溶解度命题的表述:如, T ℃时,物质甲的溶解度是 a g。
③测定、描述固体物质溶解度的关键点(命题网络与组织形式)。
④能依据溶解度的概念解读某种物质的溶解度数据(命题网络)。如,“20℃时,氯化钠的溶解度是36g”意即“20℃时,100g水中最多只能溶解36g氯化钠固体,得到136g饱和溶液。氯化钠固体多加了,则不能完全溶解。少用了,得到的是不饱和溶液。”
⑤运用溶解度概念分析、解决简单问题的基本规则、策略(产生式)。例如,应依据给定的温度选择使用对应的溶解度数据;可溶解的溶质的最大质量和用于溶解的水的质量成正比;知道t℃时某种物质的饱和溶液的溶质质量分数=该物质在t ℃时的溶解度/(100+溶解度)。
为了帮助学生形成溶解度的概念,教学设计需要考虑如下问题:
(1)如何帮助学生通过复习,掌握学习溶解度概念必须具备的知识基础:一定条件下多数固体物质在水中的溶解有一定的限度,达到限度时即形成饱和溶液;在相同条件下,不同物质在水中溶解限度不同,表现出不同的溶解性;溶解限度不仅决定于固体物质的本性,还受溶解时的温度、水量的影响;衡量物质溶解性的强弱要看相同条件下形成饱和溶液时所能溶解的量的大小。
(2)如何依据多数学生学习溶解度概念的心理过程,从具体事例的分析入手按下列程序设计教学过程,指导学生学习:
认识可以通过测定在水中所能溶解的固体物质的最大质量来衡量溶解限度的大小----测定时需要了解温度条件、确定溶解固体所用的水量、确保溶解达到了饱和状态----归纳以上操作条件和方法,得出能说明固体物质在溶剂中的溶解限度大小的命题(概念),并用严谨而简明的语句表述“溶解度”的概念---运用溶解度概念解读常见固体物质的溶解度数据,比较不同物质或统一物质在不同温度下的溶解性。
(3)学习应用溶解度概念进行有关计算(知识的迁移)。例如,从一定温度下饱和溶液的组成求溶解度;进行一定温度下固体物质溶解度和它的饱和溶液溶质质量分数的换算。认识溶质质量分数的含义能进行溶质质量分数的计算。
为了检查学生是否能正确地表征溶解度的知识,要设计适当的方式、方法,了解学生对溶解度知识的表征和提取应用能力,进行学习评价。
例如,考察学生在完成下述习题时的思路、得出的答案的正确性。
已知氯酸钾在20℃时在水中的溶解度是7.4g。
在20℃时,要使 37 g 氯酸钾完全溶解在水中,至少要用多少水?
在20℃时,用这些氯酸钾能配制成成多少克氯酸钾饱和溶液?
在20℃时,能配制出溶质质量分数为10% 的氯酸钾溶液吗?为什么?
参考文献(略)
 爱华网
爱华网