1 Notch 受体
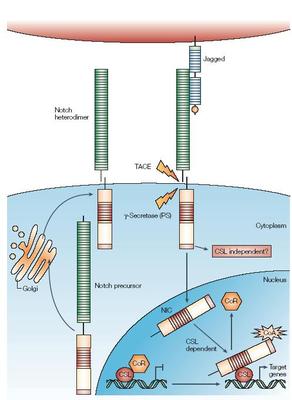
Notch受体是一个相对分子量约为 30 000 的 I 型膜蛋白,由胞外亚基和跨膜亚基组成,2 亚基之间通过Ca2+依赖的非共价键结合形成异源二聚体。胞外亚基包含一组串联排列的 EGFR 和 3 个家族特异性的 LNR 重复序列。EGFR 在Notch 受体与配体的结合中起关键作用,在果蝇中,Notch 受体的第 11 位和 12 位 EGFR 介导了其与配体的结合。LNR位于 EGFR 的下游,富含半胱氨酸,介导了 2 亚基之间 Ca2+ 依赖的相互作用。跨膜亚基包括跨膜区、RAM序列、锚蛋白重复序列、核定位序列、多聚谷氨酰胺序列以及 PEST 序列。RAM 结构是 Notch 信号效应分子 CBF1/RBPJk主要的结合部位。ANK 重复序列结构域是 Deltex、Mastermind 等的结合部位,这些蛋白对Notch信号通路有修饰作用。PEST 结构域与泛素介导的Notch 胞内段降解有关。
2 Notch 配体
Notch配体与受体一样为 I 型跨膜蛋白。果蝇 Notch配体有 2 个同源物 Delta 和 Serrate,线虫的 Notch 配体为Lag 2,故又称 Notch 配体为 DSL 蛋白。脊椎动物体内也发现了多个 Notch 配体,与 Delta同源性高的称为Delta 样分子,与 Serate 同源性高的被称作 Jagged。目前,发现人的 Notch 配体有 D lll、3、4和 Jagged l、2。配体胞外 DSL 结构域在进化中高度保守,是配体与受体结合、激活 Notch信号所必需的。Notch 配体的胞内域较短,仅70 个左右氨基酸残基,功能尚未阐明。近来研究发现,Delta1的胞内域能够诱导细胞的生长抑制。有人推测,配体胞内段可能类似与受体胞内段,具有信号转导功能,但具体机
制有待进一步研究。
3 Notch 信号传递与效应因子
迄今研究发现主要有 6种信号通路在多细胞生物的生长中发挥关键作用,分别是刺猬、 骨形态发生蛋白、 无翅、类固醇激素受体、Notch和受体酪氨酸激酶。Notch 相对于其他信号通路结构较简单,没有第二信使的参与。现有研究提出了 Notch信号活化的“三步蛋白水解模型”。首先,Notch 以单链前体模式在内质网合成,经分泌运输途径,在高尔基体内被 Furin样转化酶切割成相对分子质量为180 000 含胞外区的大片段和 120 000 含跨膜区和胞内区的小片段。两者通过 Ca2+依赖性的非共价键结合为异源二聚体,然后被转运到细胞膜。当 Notch 配体与受体结合,Notch 受体相继发生 2次蛋白水解。第一次由 ADAM 金属蛋白酶家族的 ADAM 10/Kuz 或 ADAM 17/TACE 切割为 2 个片段。N端裂解产物(胞外区)被配体表达细胞内吞,而 C 端裂解产物随后由早老素 1/2,Pen-2,Aph1 和Nicastrin 组成的γ-促分泌酶复合体酶切释放 Notch 受体的活化形式 NICD。经典的 Notch 信号通路又称为 CBF-1/RBP-Jκ依赖途径。CBF-1/RBP-Jκ 本身是 1 个转录抑制因子,能够特异性地与 DNA 序列“CGTGGGAA”相结合,并招募SMRT,SKIP,I/II 型组蛋白去乙酰化酶等蛋白形成共抑制复合物,抑制下游基因的转录。当 Notch 信号激活后,NICD通过上述酶切反应被释放进入胞核,通过 RAM 结构域及 ANK重复序列与 CBF-1/RBP-Jκ 结合使共抑制复合物解离,并募集SKIP,MAML 1 组成共激活复合体,激活下游基因的转录。Notch信号的靶基因多为碱性螺旋-环-螺旋转录抑制因子家族成员,如哺乳动物中的 HES、非洲爪蟾中的XHey-1 , 以及近来发现的 BLBP。此外, 存在非CBF-1/RBP-Jκ 依赖的 Notch 信号转导途径。最近有研究报道,果蝇 Notch 结合蛋白 Deltex是某些组织特异性非 Su(H)依赖性信号所必需的,同时发现 Deltex 也具有拮抗Notch 的功能 。
 爱华网
爱华网