1、(2009北京高考)化学与人类生活密切相关。下列说法正确的是:
A.苯酚有一定毒性,不能作消毒剂和防腐剂
B.白磷着火点高且无毒,可用于制造安全火柴
C.油脂皂化生成的高级脂肪酸钠是肥皂的有效成分
D.用食醋去除水壶中的水垢时所发生的是水解放应
2、(2009北京高考)下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.工业上电解饱和和食盐水的阳极反应:2Cl――2e-=Cl2↑
3、(2009北京高考)W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是
A.金属性:Y>ZB氢化物的沸点:X>W
C.离子的还原性:X>WD原子及离子半径:Z>Y>X
4、(2009北京高考)下列叙述正确的是
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量CuSO4固体,速率不改变
5、(2009北京高考)已知H2(g)+I2(g)2HI(g);ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度B.甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变D.甲增加0.1molH2,乙增加0.1molI2
6、(2009北京高考)甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠酸溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有2周期IVA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
7、(2009北京高考)有4中混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH③CH3COONa与NaCl④CH3COONa与NaHCO3。下列各项排序正确的是
A.pH:②>③>④>①B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④D.c(CH3COOH):①>④>③>②
8、(2009北京高考)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如在右图转化关系(部分生成物和反应条件略去)
下列推断不正确的是
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
9、(2009北京高考)丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂;
已知脂与酯可发生如下酯交换反应:RCOOR’+R’’COOHRCOOR’’+R’OH(R、R’、R’’代表烃基)
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
①A的结构简式是
A含有的官能团名称是;
②由丙烯生成A的反应类型是
(2)A水解可得到D,该水解反应的化学方程式是。
(3)C蒸汽密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为
碳60%,氢8%,氧32%,C的结构简式是。
(4)下列说法正确的是(选填序号字母)
a.C能发生聚合反应、还原反映和氧化反映
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用DAP树脂的制备。其中将甲醇与H分离的操作方法是
(6)F的分子式为C10H10O4,DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是。
10、(2009北京高考)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I.从废液中提纯并结晶出FeSO4•7H2O。
II.将FeSO4•7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液
IV.将浊液过滤,用90°C热水洗涤沉淀,干燥后得到FeCO3固体
V.煅烧FeCO3,得到Fe2O3固体
已知:NH4HCO3在热水中分解
(1)I中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是
(2)II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3)III中,生成FeCO3的离子方程式是。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42-操作是是。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O22Fe2O3+4CO2,现煅烧464.0kg的FeCO3,得到316.8kg产品,若产品中杂质只有FeO,则该产品中FeCO3的质量是kg(摩尔质量/g·mol-1;FeCO3116;Fe2O3160;FeO 72)
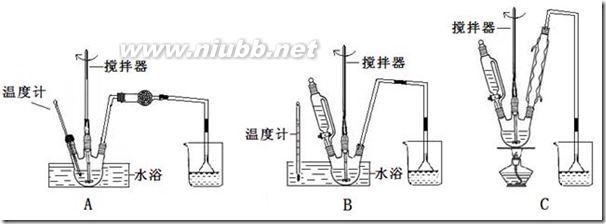
11、(2009北京高考)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将NO成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
(5)该小组得出的结论所依据的实验现象是
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中
硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计
了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
12、(2009北京高考)以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)将燃烧黄铁矿的化学方程式补充完整
4+11O22Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160gSO3气体与H2O化合放出260.6kJ的热量,该反应的热化学方程式是。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是%;若铵盐质量为15.00g。浓硫酸增加的质量为。(计算结果保留两位小数)
《2009年高考(北京理综卷)》参考答案
1、C
2、A
3、B
4、C
5、C
6、D
7、B
8、A
9、(1)①CH2=CHCH2Cl碳碳双键氯原子②取代反应
(2)CH2=CHCH2Cl+H2O CH2=CHCH2OH+HCl
(3)CH3COOCH2CH=CH2
(4)ac d
(5)蒸馏
(6)
10、(1)Fe+2Fe3+=3Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2OFe(OH)2+2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
(3)Fe2++2HCO3-=FeCO3↓+CO2↑+H2O4FeCO3+6H2O+O2=4Fe(OH)3↓+4CO2↑(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0
11、(1)3mol·L-1稀硝酸、浓硝酸、氢氧化钠溶液
(2)通入CO2一段时间,关闭弹簧夹,将装置⑤中的导管末端伸入倒置的烧瓶内
(3)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(4)将NO2转化为NO3NO3+H2O=2HNO3+NO
(5)装置③中液面上方气体仍为无色,装置④中液面上方气体有无色变为红棕色
(6)ac d
12、(1)FeS2
(2)2SO2+O22SO3
(3)ab d
(4)SO3(g)+H2O(l)=H2SO4(l);△H=-130.3kJ·mol-1
(5)①SO2+Br2+2H2O=4H++2Br-+SO42-②14.562.31g
 爱华网
爱华网