化学“一学就会,一听就懂,一多就乱,一长就忘”?做好复习就没这些问题了。下面是小编为大家整理的高中化学键知识点,希望对大家有所帮助。
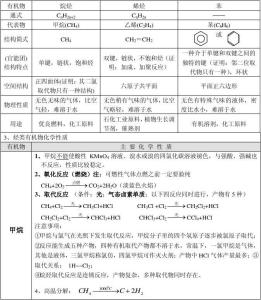
高中化学键知识点(一)1、只由共价键形成的化合物称为共价化合物
2、离子化合物可能含有共价键,共价化合物一定不含离子键。这句话可以结合离子化合物和共价化合物的概念去理解。
3、原子间通过共用电子对所形成的相互作用,叫做共价键。
4、化学键包括离子键,共价键,金属键。氢键和分子间作用力不属于化学键。
5、关于共价化合物的结构式,通常用一根短线(可以是竖线或横线或斜线,不过斜线不推荐使用)来表示一对共用电子对,未成键的电子不用写出来(例如HCl的结构式为:H—Cl),只有共价化合物才有结构式,因为短线代表的是共用电子对。
6、同种物质中可以同时存在极性键和非极性键。(极性键和非极性键统称为共价键)
高中化学键知识点(二)1、分子间作用力只存在于多数共价化合物和绝大多数非金属单质分子之间,以及稀有气体分子之间,不存在于离子化合物之间(离子化合物无法形成分子,这个很好理解,因为分子的概念是“分子由原子组成”,而组成离子化合物的是离子而不是原子)
2、分子间作用力以及氢键主要影响物理性质,而化学键主要影响化学性质。
3、氢键不是化学键,比化学键弱得多,比分子间作用力要强。
4、通常N、O、F三种元素的氢化物易形成氢键,常见的易形成氢键的化合物有:水,氢氟酸,氨气等。氢键与化学键类似,都需要能量来破坏,形成氢键的
5、分子间作用力范围很小。一般来说,分子质量越大,分子间作用力越大,(这跟以前地理学的太阳成为太阳系的中心天体的道理类似,原因也是因为太阳质量巨大,但不完全一样)物质的熔沸点越高。(比如同种物质的固态,这种物质分子间作用力越大,那么它的固态越不容易变成液态和气态,一般来说,同种物质的分子作用力最小的状态是气态)
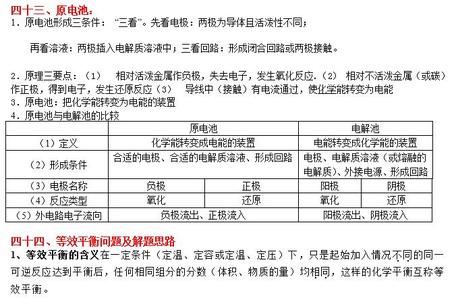
高中化学键知识点(三)1、带相反电荷离子之间的相互作用称为离子键,也就是说,成键的微粒为阴、阳离子且均是稳定的离子,阴、阳离子间的排斥和吸引处于平衡状态。
2、离子键存在于所有强碱、大多数盐、与活泼金属氧化物之中。
3、在共价化合物中,同种原子间形成的共价键就叫做非极性键,不同原子间形成的共价键就叫做极性键。(对于极性键和非极性键,可以这样理解,极性和非极性说明的就是是否有相对电极。在形成共价键时,同种原子对共用电子对的吸引力是一样的,所以不产生相对正负电极,所以说成非极性共价键;而不同原子,对共用电子对的吸引力是不同的,吸引力较强的带相对负电,反之,则带相对正电,这样,产生了相对正负电极,所以就可以说成为极性共价键。)
4、需要特殊记忆的阳离子是铵根离子,与酸根(或酸式根)形成的盐也是离子化合物。从这条知识可以看出,不含金属元素的化合物可能也是离子化合物。
 爱华网
爱华网