化学科目的记忆内容非常多,分清主次将对考试大有裨益。下面是小编为您带来的高考化学必考内容,希望对大家有所帮助。
高考化学必考内容(一)1.化学实验(8个)
①常用仪器的主要用途和使用方法(主要是原理)
②实验的基本操作(主要是原理)
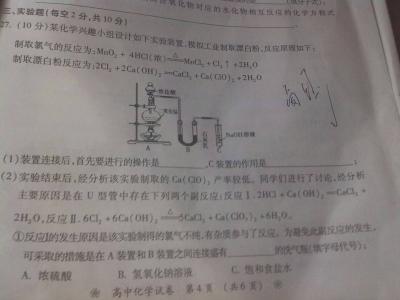
③常见气体的实验室制法(包括所用试剂、仪器、反应原理、收集方法)
④实验室一般事故的预防和处理方法(安全意识培养)
⑤常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别
⑥运用化学知识设计一些基本实验或评价实验方案。
⑦探究性实验
⑧根据实验现象、观察、记录、分析或处理数据,得出正确结论。(分析处理数据这几年没考,但要关注这个问题)
2.化学计算(7个)
①有关物质的量的计算
②有关溶液浓度的计算
③气体摩尔体积的计算
④利用化学反应方程式的计算
⑤确定分子式的计算
⑥有关溶液PH值与氢离子浓度、氢氧根离子浓度的计算
⑦混合物的计算
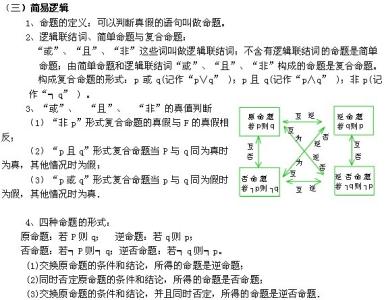
高考化学必考内容(二)1、氧化还原反应方程式的书写
2、离子反应方程式的三重境界
3、元素周期表律
4、10、18电子粒子及其转化
5、金属元素及其化合物
6、非金属元素及其化合物
7、热化学方程式与盖斯定律
8、几种重要的商业电池
9、燃料电池及其应用
10、电解原理及其应用
11、反应速率
12、三大平衡
13、溶液中的粒子浓度关系
14、碳原子的立体结构
15、等价氢原子及其应用
16、二价基团插入法及其应用
17、取代与缩聚反应
18、加成与聚合反应
19、羟醛缩合反应
20、有机合成与推断
21、实验中的仪器与操作原则
22、实验室气体制备原则
23、物质的分离提纯原则
24、物质的鉴别与鉴定原则
25、探究实验及其策略
27、几种重要的无机明星物质
28、几种重要的有机明星物质
29、几种重要物质的工业制备
30、工业流程试题解题策略
高考化学必考内容(三)1.有机鉴别时,注意用到水和溴水这二种物质。
例:鉴别:乙酸乙酯(不溶于水,浮)、溴苯(不溶于水,沉)、乙醛(与水互溶),则可用水。
2、取代反应包括:卤代、硝化、磺化、卤代烃水解、酯的水解、酯化反应等;
3、最简式相同的有机物,不论以何种比例混合,只要混和物总质量一定,完全燃烧生成的CO2、H2O及耗O2的量是不变的。恒等于单一成分该质量时产生的CO2、H2O和耗O2量。
4、一些特殊的反应类型:
① 化合物+单质 化合物+化合物 如:
Cl2+H2O、H2S+O2、、NH3+O2、CH4+O2、Cl2+FeBr2
② 化合物+化合物 化合物+单质
NH3+NO、 H2S+SO2 、Na2O2+H2O、NaH+H2O、Na2O2+CO2、CO+H2O
③ 化合物+单质 化合物
PCl3+Cl2 、Na2SO3+O2 、FeCl3+Fe 、FeCl2+Cl2、CO+O2、Na2O+O2
5.条件不同,生成物则不同
点燃点燃1、2P+3Cl2===2PCl3(Cl2不足) ; 2P+5Cl2===2 PCl5(Cl2充足)
点燃点燃2、2H2S+3O2===2H2O+2SO2(O2充足) ; 2H2S+O2===2H2O+2S(O2不充足)
缓慢氧化点燃3、4Na+O2=====2Na2O 2Na+O2===Na2O2
CO2适量
6、Ca(OH)2+CO2====CaCO3↓+H2O ; Ca(OH)2+2CO2(过量)==Ca(HCO3)2
点燃点燃5、C+O2===CO2(O2充足) ; 2 C+O2===2CO (O2不充足)
7、AlCl3+3NaOH==Al(OH)3↓+3NaCl ; AlCl3+4NaOH(过量)==NaAlO2+2H2O
8、NaAlO2+4HCl(过量)==NaCl+2H2O+AlCl3 NaAlO2+HCl+H2O==NaCl+Al(OH)3↓
9、Fe+6HNO3(热、浓)==Fe(NO3)3+3NO2↑+3H2O Fe+HNO3(冷、浓)→(钝化)
Fe不足10、Fe+6HNO3(热、浓)====Fe(NO3)3+3NO2↑+3H2O
Fe过量 Fe+4HNO3(热、浓)====Fe(NO3)2+2NO2↑+2H2O
Fe不足Fe过量11、Fe+4HNO3(稀)====Fe(NO3)3+NO↑+2H2O 3Fe+8HNO3(稀) ====3Fe(NO3)3
高考化学必考内容(四)
1.弱碱阳离子只存在于酸性较强的溶液中.如Fe3+、Al3+、Zn2+、Cu2+、NH4+、Ag+ 等均与OH-不能大量共存.
2.弱酸阴离子只存在于碱性溶液中。如CH3COO-、F-、CO32-、SO32-、S2-、PO43-、 AlO2-均与H+不能大量共存.
3.弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存.它们遇强酸(H+)会生成弱酸分子;遇强碱(OH-)生成正盐和水. 如:HSO3-、HCO3-、HS-、H2PO4-、HPO42-等
4.若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存.
如:Ba2+、Ca2+与CO32-、SO32-、PO43-、SO42-等;Ag+与Cl-、Br-、I- 等;Ca2+与F-,C2O42- 等
5.若阴、阳离子发生双水解反应,则不能大量共存.
3+-2--2---2- 如:Al与HCO3、CO3、HS、S、AlO2、ClO、SiO3等
Fe3+与HCO3-、CO32-、AlO2-、ClO-、SiO32-、C6H5O-等;NH4+与AlO2-、SiO32-、ClO-、CO32-等
6.若阴、阳离子能发生氧化一还原反应则不能大量共存.
3+-2--+---2-2-2+-+ 如:Fe与I、S;MnO4(H)与I、Br、Cl、S、SO3、Fe等;NO3(H)与
上述阴离子;
S2-、SO32-、H+
7.因络合反应或其它反应而不能大量共存
如:Fe3+与F-、CN-、SCN-等; H2PO4-与PO43-会生成HPO42-,故两者不共存.
 爱华网
爱华网