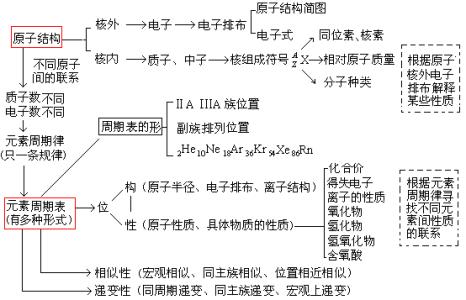
学习化学就是学习物质的结构与变化。下面是小编为您带来的北师大高一化学第一章复习总结,希望对大家有所帮助。
北师大高一化学第一章复习总结:一. 教学内容:
第一章复习总结
二. 教学目的
1、了解化学学科的研究对象、学科特点、研究方法、发展趋势。
2、掌握钠和氯气的性质,了解研究物质性质的基本方法和程序。
3、掌握以物质的量为核心的相关概念及其换算关系。
三. 教学重点、难点
钠和氯气的性质及物质的量的有关概念
四. 知识分析
(一)走近化学科学
化学是一门在原子、分子水平上研究物质的自然科学,化学家可以在微观层次上操纵原子、分子,不断拓展探索空间。
1、化学是一门具有创造性、实用性的科学
2、化学的形成和发展道路漫长
3、化学的探索空间十分广阔
(二)研究物质的方法和程序
1、研究物质性质的基本方法:观察、实验、比较、分类。
2、研究物质性质的一般程序:观察、预测、实验、结论。
3、钠的性质:
(1)物理性质:钠是银白色具有金属光泽质软的金属,密度和熔点都比较低。
(2)化学性质:
与非金属反应 :与O2、 Cl2 、 S等
4Na+O2=2Na2O 2Na+O2
Na2O2
Na2O属于碱性氧化物,而 Na2O2 性质较复杂,
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
与水反应:将钠加入滴有酚酞的水中现象——浮、游、熔、响、红。
2Na+2H2O=2NaOH+H2↑
与盐溶液反应:如氯化铁、硫酸铜溶液等
4、氯气的性质:
(1)物理性质:通常氯气是一种黄绿色有刺激性气味的有毒气体,1体积水能溶解2体积氯气,氯气的沸点较低,易液化,液化后称液氯。
(2)化学性质:
与金属反应:与 Na、Fe、Cu 等剧烈反应
2Fe+3Cl2
2FeCl3
与非金属反应:与H2、P等反应
与水反应:Cl2+H2O=HCl+HClO
氯水的成分:成分复杂、性质多样
HClO的性质
与碱液反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(三)物质的量
1、基本概念:
物质的量(n):
摩尔(mol):
阿伏加德罗常数(NA):
摩尔质量(M):
气体摩尔体积(Vm):
物质的量浓度(CB):
2、转化关系:
各物理量以物质的量为中心的转化关系如下:n=N/NA=m/M=V/Vm=CV
3、实验:配制一定物质的量浓度的溶液
(四)单元专题探究
1、任何求混合气体的平均相对分子质量
●由标准状况下混合气体的密度求: M=22.4p
●由气体的相对密度求: MA=DMB (D=pA/PB)
●由混合气体的总质量、总物质的量求:M=m/n
●由混合气体各组分相对分子质量和体积分数求:M=M1V1%+M2V2%+M3V3%+...
2、阿伏加德罗定律应用
●内容:在同温同压下,相同体积的气体含有相同的气体分子数。
●推论:①同温同压时,V1/V2=n1/n2
②同温同体积时,P1/P2=n1/n2=N1/N2
③同温同压等质量时,V1/V2=M1/M2
④同温同压时,M1/M2=p1/p2
3、物质的量浓度计算思维起点的选择
●从定义式出发:物质的量浓度定义式为C=n/V,欲求C,先分别求出n及C。
●从换算式出发:溶液物质的量浓度与溶质的质量分数、密度的换算公式为C=(1000pw)/M
●从“守恒”的观点出发:
①稀释前后,“溶质的物质的量守恒”,即C1V1=C2V2
②溶液中“微粒之间电荷守恒”,即溶液呈电中性
③质量守恒
【典型例题】
例1:下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A. ①②③ B. ①②③⑥ C. ③⑥ D. ③④⑥
答案:C
解析:能使干燥的石蕊试纸先变红后褪色的物质,应具有酸性和漂白性等性质。在所给的六种物质中, ①②只存在Cl2分子,既无酸性,也无漂白性。④中存在的是Cl2分子和酒精分子,也没有酸性和漂白性。⑤中只存在H+和Cl-及水分子,只能使蓝色石蕊试纸变红,却不能使之褪色。只有③和⑥中,既有酸性也有漂白性(HClO),因此应选C。
点评:氯气之所以能使湿润的有色布条褪色,是因为:
Cl2+H2O=HCl+HClO的缘故,实质起漂白作用的是HClO,液氯和氯水是不一样的。因此,解题一定要认真分析,仔细考虑,抓住本质。
例2:下列说法中正确的是(NA表示阿伏加德的罗常数的值)
A. 标准状况下,以任意比例混和的甲烷和一氧化碳的混和物22.4L,所含的分子数为NA
B. 46g钠变成钠离子时,失电子数为NA
C. 常温常压下,活泼金属从盐酸中置换出1mol H2,转移的电子数为2NA
D. 常温常压下,1mol氦气含有的核外电子数为4NA
答案:AC
解析:标准状况下,1mol任何气体所占的体积都约为22.4L,这里的“气体”可以是混合物,则A选项正确;46g钠应失去电子2NA,B选项错误;2H++2e-=H2↑,即生成1mol H2,必然转移2mol电子,C选项正确;氦气是单原子分子,其原子序数是2,1mol 氦含有2mol电子,则D选项错误。
点评:解答有关阿伏加德罗常数(NA)的题目,必须注意下列一些细微的知识点:
(1)状况问题:水在标准状况时为液态或固态;SO3在标准状况下为固态,常温常压下为液态;
(2)某些物质的分子中原子的个数,如Ne,O3,白磷等;
(3)转移电子数的求算。
例3:标准状况下,nL HCl 气体溶于m mLH2O中得密度为p g.cm-3的R L的盐酸,则此盐酸的物质的量浓度为( )
A. n/(22.4R) mol·L-1 B. 1000np/(36.5n+22.4m) mol·L-1
C. n/22.4 mol·L-1 D. 1000p/(36.5n+22.4m) mol·L-1
答案:A B
解析:C=(nL/22.4·L.mol-1)/RL =n/(22.4R ) mol·L-1
C=(n/22.4)/[(n/22.4×36.5 +1×m )/p×103 ]=(1000pn) /(36.5n+22.4m) mol·L-1
点评:物质的量的浓度定义中是溶质的物质的量比溶液的体积,而不是水的体积,此种情况,要善于通过溶液密度转化表示出溶液体积,然后由物质的量浓度定义式去得出结果。
例4:在某温度时,一定量的元素A的氢化物AH3在一定体积的密闭容器中可完全分解成两种气体单质,此时压强增加了75%,则A单质的一个分子中有_____个A原子,AH3分解的化学方程式为___________________________________________________.
答案:4;4AH3=A4+6H2
解析:由阿伏加德罗的推论可知:同温同体积时,P1/P2=n1/n2=N1/N2
得知反应前后气体的分子数之比为 1:1.75=4:7,即反应式左边和右边的气体系数和之比为4:7,再由H原子守恒不妨先设反应式为4AH3=Ax+6H2 ,再由H原子守恒得x为4。
点评:阿伏加德罗定律的应用十分广泛,由定律可以得到很多推论,至于用什么推论解答,要认真分析题意,看看题目是什么条件下气体的什么物理量的变化,如本题是同温、同体积下压强的变化,由推论可得分子数变化,再由质量守恒推得问题答案。
例5:400ml 某浓度的NaOH溶液恰好与5.8 L Cl2 (标准状况)完全反应,计算:
(1)生成的NaClO的物质的量。
(2)该溶液中NaOH的物质的量浓度。
解:(1)设生成的NaClO的物质的量为n(NaClO).
2NaOH+Cl2=NaCl+NaClO+H2O
1mol 1mol
5.8L/Vm n(NaClO)
n(NaClO)=(5.8L×1mol ) / 22.4L . mol-1×1mol=0.26mol
(2)设该溶液中NaOH的物质的量浓度为C(NaOH)
2NaOH + Cl2=NaCl+NaClO+H2O
2mol 1mol
C(NaOH)×0.4 L 5.8L/Vm
C(NaOH)=2mol×5.8L / (1mol×0.40L×22.4 L mol-1)=1.3 mol·L-1
答:生成NaClO的物质的量为0.26 mol;该溶液中NaOH的物质的量浓度为1.3 mol·L-1。
点评:物质的量用于化学方程式的关键是首先明确化学方程式表示的意义,化学计量数可以表示该物质的物质的量,格式要求列比例式时同一物质要物理量相同,不同物质可以相同,也可以相当。比如物质的量与质量相当、物质的量与气体体积相当、质量与气体体积相当。不管什么方式,都要注意数据带单位,否则计算混乱,最终计算失败。
【模拟试题】(答题时间:40分钟)
一、选择题(每题有1或2个正确答案)
1. 某纪念币外观有银白色的金属光泽,一些同学认为它可能是铁制成的,在讨论时有同学提出,我们可以先拿磁铁来吸一下。就“拿磁铁来吸一下”这一过程而言,属于科学探究中的( )
A. 实验 B. 假设 C. 观察 D. 建模
2. 在下列物质中,与6克CO(NH2)2的含氮量相同的是( )
A. 0.1mol (NH4)2SO4 B. 6克NH4NO3
C. 22.4L NO2(标准状况) D. 0.1mol NH3
3. 水蒸气中常含有部分(H2O)2,需确定(H2O)2的存在可采用的方法是( )
A. 1L水蒸气冷凝后与足量的金属钠反应,测产生氢气的体积
B. 1L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C. 该水蒸气冷凝后,测水的pH
D. 该水蒸气冷凝后,测氢氧原子比
4. 下列实验操作正确的是( )
A. 将氢氧化钠固体放在滤纸上称重
B. 用10mL 量筒量取8.58mL蒸馏水
C. 用加热的方法提纯含有少量碳酸氢钠的碳酸钠
D. 用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
5. 某条件下,已知由C2H4和O2组成的混和气体的密度为相同条件下H2密度的14.5倍,则混和气体中C2H4的质量分数为( )
A. 75% B. 25% C. 27.6% D. 72.4%
6. 下列说法正确的是( )
A. 标准状况下,6.02×1023个分子所占的体积约是22.4L
B. 0.5mol H2 所占体积为11.2L
C. 标准状况下,1mol水的体积为22.4L
D. 标准状况下,28g CO 与N2的混和气体的体积约为22.4L
7. 将一定量的MgCl2溶于90g水中,使每100个水分子中有一个Cl-,这一定量MgCl2的物质的量为( )
A. 0.09mol B. 0.025mol C. 0.05mol D. 0.1mol
8. 取一小块金属钠放在燃烧匙里加热,下列实验现象:
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质。描述正确的是( )
A. ①② B. ①②③ C. ①④⑤ D. ④⑤
9. 分别与1mol Cl2发生反应,消耗质量最小的物质是( )
A. Fe B. Cu C. Mg D. Na
10. 在同温同压下,将由H2和Cl2组成的混和气体 200mL引发化学反应,反应后的气体体积仍为200mL。下列对化学反应状况的判断中正确的是( )
A. 若反应后的气体有刺激性气味,则一定是Cl2没有完全反应
B. 若反应后的气体没有颜色,则一定是H2,Cl2都已完全反应
C. 若反应后的气体略带黄绿色,则一定是H2已完全反应
D. 若反应后的气体遇水显漂白性,则一定是Cl2未完全反应
二、填空题
11 有NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,分别与足量的硝酸银溶液反应,则生成沉淀的物质的量之比为________________.若生成的沉淀的质量相等,则三种溶液中溶质的物质的量之比为__________。
12. 相同质量的SO2和SO3,所含分子的数目之比为_________;所含O的物质的量之比为________。
13. 请按要求填空
(1)用已准确称量的1.06gNa2CO3固体配制0.100mol.L-1Na2CO3溶液100mL,所需的仪器是__________________________。
(2)除去NaNO3固体中混有少量KNO3所进行的实验操作依次为_______、蒸发、结晶、_________。
(3)除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式)____________.
三、计算题
14. 现用Zn与实验室中的盐酸反应制取4.48LH2(标准状况)
(1)如果选用所贴标签为2.0mol/L的盐酸,至少需要盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g/mL)的盐酸,至少需要盐酸多少毫升?
15. 在标准状况下氢气和一氧化碳的混和气体7L,质量为2.25g,求H2和CO质量分数和体积分数。
【试题答案】
一、选择题
1. A 2. A 3. AB 4. C 5. D 6. D 7. B 8. C 9. C 10. CD
二、填空题
11. 1:2:3 ; 6:3:2
12. 5:4 5:6
13.(1) 100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管
(2)溶解 过滤
(3)BaCl2或Ba(OH)2、K2CO3、HCl
三、计算题
14. (1)200mL (2)200mL
15. 质量分数:H2 22.2% CO 77.8%
体积分数: H2 80% CO 20%
以上就是小编分享的北师大高一化学第一章复习总结全部内容,欢迎翻阅。
 爱华网
爱华网